Precision psychiatry and neuroimaging: Towards improved treatment success in psychosis
Background In the future, clinicians might use information about neurobiological processes, obtained through imaging techniques, to guide personalized prevention and intervention strategies for psychosis and related disorders. However, this requires more knowledge about these individuals’ brain function.
Aim To advance the current knowledge on neurobiological processes in patients with schizophrenia spectrum disorders (SSD) and individuals at increased risk of these disorders.
Method We conducted a systematic review to address dopaminergic alterations in individuals at increased risk of SSD. Additionally, we acquired PET and MRI scans in patients with SSD and controls to obtain information about neurotransmitters, such as dopamine.
Results Striatal dopamine synthesis capacity was altered in individuals at increased risk of developing SSD compared to controls. In healthy volunteers, the concentration of neuromelanin, a breakdown product of dopamine, in the substantia nigra was negatively associated with striatal dopamine synthesis capacity. This was not the case for patients with SSD.
Conclusion We report differences in neurobiological processes and their interrelationships between patients with psychotic and related disorders and controls. This information may help predict psychosis susceptibility and treatment effectiveness in the future. Our findings can therefore contribute to the development of personalized treatments and better counselling of the patient.
Schizofreniespectrumstoornissen zijn ernstige psychische stoornissen, die een grote impact hebben op het leven van patiënten, hun naasten en het zorgsysteem. In dit artikel verstaan we onder ‘schizofreniespectrumstoornissen’ de volgende DSM-5-classificaties: waanstoornis, kortdurende psychotische stoornis, schizofreniforme stoornis, schizofrenie, schizoaffectieve stoornis en ongespecificeerde/andere gespecificeerde schizofreniespectrum- of andere psychotische stoornis.
Verschillende factoren spelen een rol bij het ontstaan van schizofreniespectrumstoornissen, zoals middelengebruik, trauma en genetische belasting. Blootstelling aan dergelijke factoren en beschermende omstandigheden bepalen tezamen de gevoeligheid van een persoon voor een psychose. Sommige mensen lopen een verhoogd risico op het krijgen van een schizofreniespectrumstoornis, zoals personen met het 22q11.2-deletiesyndroom (22q11DS). Bij hen ontbreekt een deel van chromosoom 22.1 Kinderen met 22q11DS worden vaak geboren met een hartafwijking of een afwijkend gehemelte.2 Tevens krijgt 20-40% van hen een schizofreniespectrumstoornis.3 Dit percentage is veel hoger dan in de algemene bevolking (1-3%).
De behandeling van schizofreniespectrumstoornissen kan bestaan uit biologische, psychologische en/of psychosociale interventies. Een van de doelen van deze behandeling kan zijn het verminderen van psychotische symptomen, waarbij antipsychotica een grote rol spelen. De behandeling met eerste- en tweedegeneratieantipsychotica is echter in 25-33% van de gevallen niet effectief.4 Momenteel weten we niet welke personen met een verhoogd risico op een schizofreniespectrumstoornis, onder wie patiënten met 22q11DS, deze ziekte daadwerkelijk zullen krijgen. Daarnaast weten behandelaren bij het starten van een medicamenteuze behandeling niet of een bepaald antipsychoticum werkzaam zal zijn voor een individuele patiënt.
Wanneer we psychosegevoeligheid en behandeleffectiviteit zouden kunnen voorspellen, kunnen artsen en patiënten gerichter keuzes maken over preventie- en interventiemiddelen. Zo zouden patiënten met een schizofreniespectrumstoornis die een grote kans hebben op een slechte respons op eerstelijnsantipsychotica bijvoorbeeld eerder kunnen starten met clozapine.
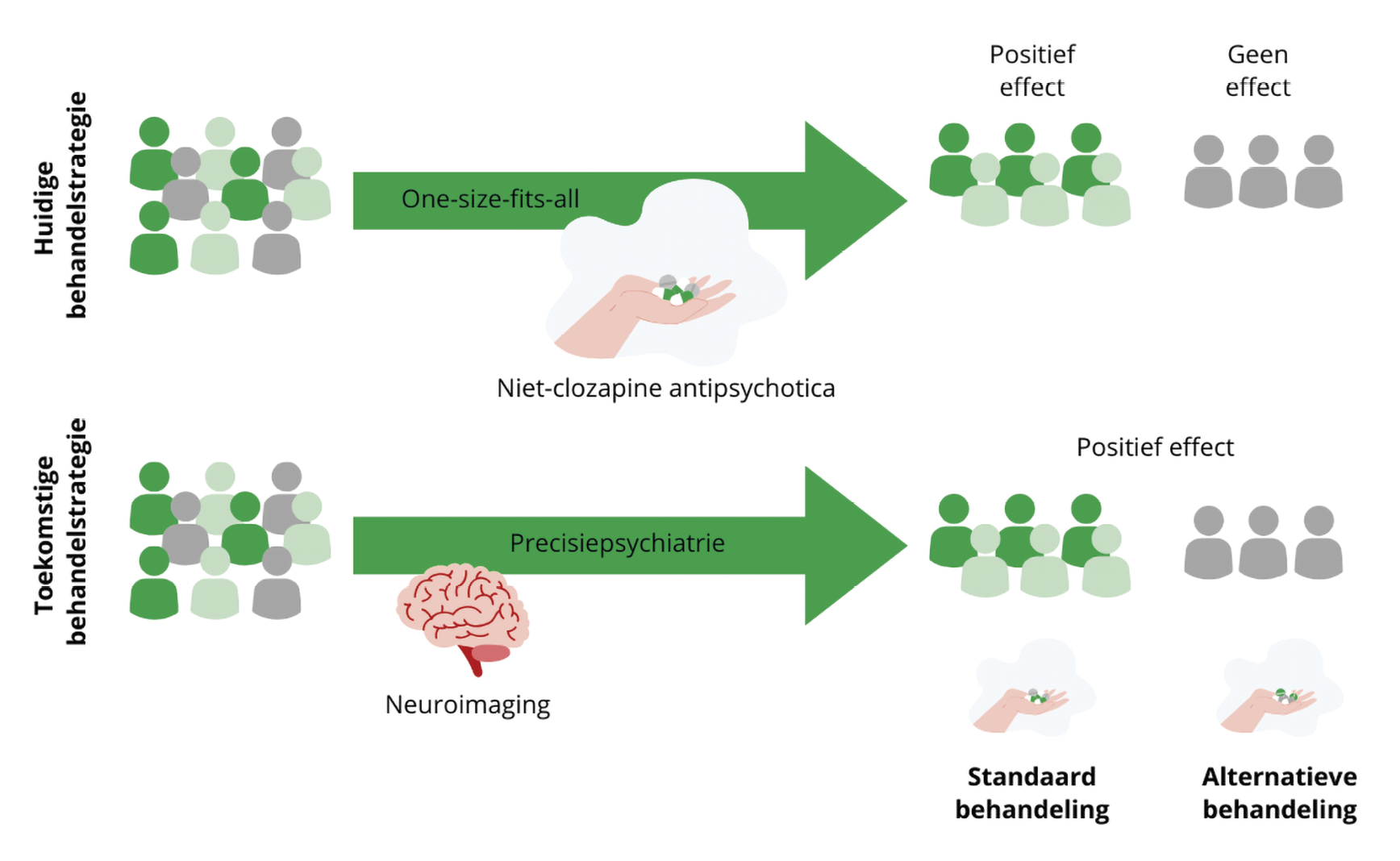
Precisiepsychiatrie
Het aanbieden van preventie- of interventiestrategieën die aansluiten bij het individu wordt precisiepsychiatrie genoemd. Momenteel worden medicamenteuze preventie- en interventiestrategieën binnen de ggz vaak toegepast via een ‘vallen en opstaan’-strategie. Hierbij proberen patiënten eerst medicamenteuze behandeling A en als dit niet werkt, stappen zij over naar medicamenteuze behandeling B, enzovoort. Elke patiënt volgt dezelfde medicamenteuze behandelrichtlijn, een ‘one-size-fits-all’-behandelstrategie (figuur 1). Dit is niet ideaal, aangezien deze behandelrichtlijn ontwikkeld is voor de gemiddelde patiënt en die bestaat niet. Dit betekent in de praktijk dat sommige patiënten meer of juist minder baat hebben bij het volgen van de richtlijn. Net als in andere medische disciplines zoals oncologie, zouden we graag schizofreniespectrumstoornissen subtyperen en een (medicamenteuze) behandeling aanbieden die zo veel mogelijk aansluit bij het subtype van de patiënt.5,6 Hierdoor wordt de kans op een positieve behandeluitkomst mogelijk het grootst.
Figuur 1. Huidige en toekomstige behandelstrategieën
Technologisch hulpmiddel
Eén manier om precisiepsychiatrie in de psychosezorg te implementeren is door gebruik te maken van een technologisch hulpmiddel, gebaseerd op voorspellende modellen. Dit hulpmiddel zou, op basis van informatie verstrekt door de patiënt en/of behandelaar, een indicatie kunnen geven van het risico op het ontstaan van een schizofreniespectrumstoornis bij personen met 22q11DS of de kans dat een specifieke medicamenteuze behandeling werkzaam zal zijn bij patiënten met schizofreniespectrumstoornissen. Welke informatie nodig is voor het inschatten van psychosegevoeligheid of behandeleffectiviteit is momenteel onduidelijk.
Eén mogelijkheid is het gebruiken van informatie over het (dis)functioneren van verschillende neurotransmittersystemen in de hersenen, zoals het dopaminesysteem. In eerder onderzoek vond men dat de aanmaak van dopamine in het striatum verhoogd is bij patiënten met schizofreniespectrumstoornissen, maar niet bij therapieresistente patiënten.7 Informatie over het dopaminesysteem kan verkregen worden met beeldvormende technieken, zoals positronemissietomografie (PET) en MRI. Zo kan men met 18F-fluorodopa(FDOPA)-PET kijken naar de aanmaak van dopamine in het striatum (een gebied in het midden van de hersenen; figuur 2). Met neuromelaninegevoelige MRI (NM-MRI) kan men de concentratie van neuromelanine – een afbraakproduct van dopamine – meten in cellen van de substantia nigra (een gebied in de hersenstam; figuur 2).
Figuur 2. Beeldvormende technieken8
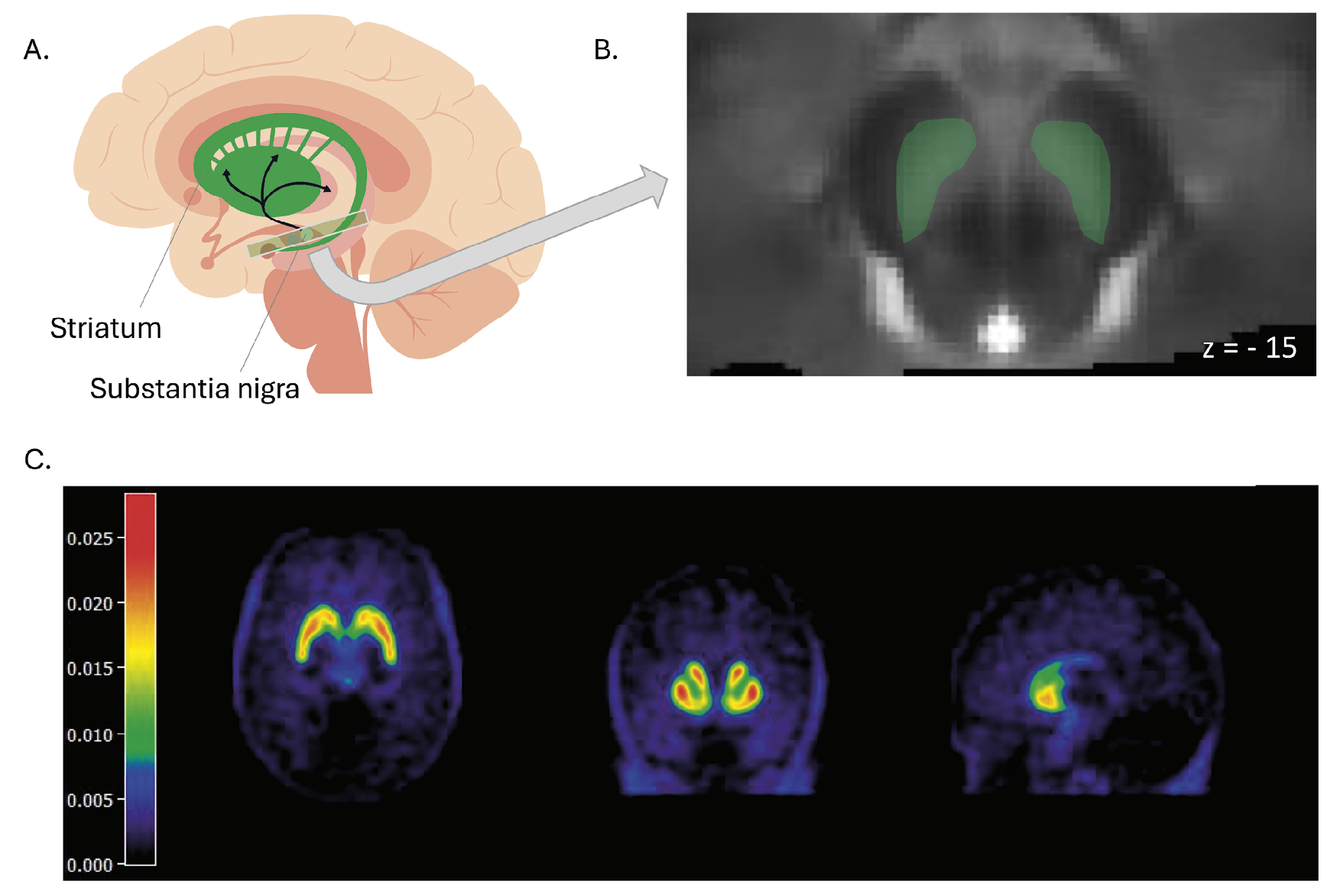
A. Sagittale weergave van de hersenen. De zwarte pijlen geven het nigrostriatale dopaminecircuit weer, dat vanuit de substantia nigra naar het striatum projecteert. B. Transversale weergave van het gemiddelde NM-MRI-signaal in de hersenen van 28 personen (12 patiënten met schizofreniespectrumstoornissen en 16 gezonde controlepersonen). De doorsnede komt overeen met de rechthoek uit deel A. In groen is de substantia nigra weergegeven. C. Transversale (links), coronale (midden) en sagittale (rechts) weergave van de gemiddelde opname van 18F-FDOPA in de hersenen van gezonde controlepersonen (n = 16).8
Vanwege de complexiteit van schizofreniespectrumstoornissen is het goed mogelijk dat naast gegevens verkregen met beeldvormende technieken aanvullende informatie nodig is om juiste voorspellingen te maken, zoals klinische en sociaal-demografische gegevens. Voordat we gepersonaliseerde preventie- en interventiestrategieën kunnen aanbieden in de klinische praktijk aan patiënten met psychotische en aanverwante stoornissen, hebben we meer kennis nodig over neurobiologische processen in de hersenen van deze individuen.
Doel
Het doel van het proefschrift ‘De hobbelige weg van psychotische stoornissen: Op weg naar gepersonaliseerde behandelingen voor psychotische en aanverwante stoornissen via hersenonderzoek en beeldvormende technieken’ was het vergroten van de kennis over neurobiologische processen bij patiënten met schizofreniespectrumstoornissen, evenals personen met een verhoogd risico hierop, gebruikmakend van beeldvormende technieken. Hiermee trachten wij in dit proefschrift bij te dragen aan de ontwikkeling van gepersonaliseerde medicamenteuze behandelingen voor psychotische en aanverwante stoornissen.
De belangrijkste onderzoeksvragen van dit proefschrift waren:
1. Wijkt het dopaminesysteem van personen met een verhoogd risico op het ontstaan van een schizofreniespectrumstoornis af van dat van gezonde controlepersonen? (Systematisch literatuuronderzoek.)
2. Wat is de relatie tussen de aanmaak van dopamine in het striatum en de concentratie van neuromelanine in de substantia nigra (gemeten met respectievelijk PET en MRI) bij patiënten met schizofreniespectrumstoornissen en gezonde vrijwilligers? (Neuro-imagingonderzoek.)
Toelichting: Clinici en onderzoekers gebruiken beeldvormende technieken – zoals PET of single photonemissiecomputertomografie (SPECT) – om het dopaminesysteem bij mensen te onderzoeken. Hierbij wordt een kleine hoeveelheid van een radioactieve stof geïnjecteerd in de bloedbaan. Aangezien sommige patiënten bang zijn voor radioactiviteit en deze onderzoeken duur en tijdrovend zijn, zouden we het dopaminesysteem bij voorkeur onderzoeken met toegankelijkere en goedkopere methodes, zoals NM-MRI. Deze techniek meet de concentratie van neuromelanine in de substantia nigra. Neuromelanine is een afbraakproduct van dopamine, dat na verloop van tijd ophoopt in de substantia nigra. Bij patiënten met de ziekte van Parkinson wordt een afname gezien in NM-MRI-signaal in de substantia nigra, overeenkomstig met de degeneratie van dopaminehoudende cellen bij deze patiëntengroep. Het is nog onbekend hoe metingen van neuromelanine samenhangen met traditionele metingen van het dopaminesysteem.9
3. Kunnen klinische, familiaire en sociodemografische gegevens, en gegevens over de leefomgeving van patiënten met schizofreniespectrumstoornissen, de behandelrespons op antipsychotica voorspellen? (GROUP-studie.)
Toelichting: Naast neuro-imagingdata is het mogelijk dat andere informatie gebruikt kan worden om psychosegevoeligheid en behandeleffectiviteit te voorspellen, zoals klinische en sociaal-demografische gegevens.
Methode
Systematisch literatuuronderzoek
Dit onderzoek werd geregistreerd bij PROSPERO (CRD42020173412) en uitgevoerd overeenkomstig met de PRISMA-aanbevelingen voor systematisch literatuuronderzoek. Via PubMed en PsycINFO zochten we naar eerdere studies waarin men met beeldvormende technieken verschillende aspecten van het dopaminesysteem bestudeerde bij personen met een verhoogd risico op het ontstaan van een schizofreniespectrumstoornis, zoals de aanmaak van dopamine en de beschikbaarheid van dopamine D2/D3-receptoren in de hersenen. We verdeelden de deelnemers aan deze onderzoeken in drie risicogroepen en één controlegroep. De eerste risicogroep bestond uit personen met een klinisch hoog risico, zoals individuen met subklinische klachten. Tot de tweede risicogroep behoorden personen met een genetisch hoog risico, zoals individuen met 22q11DS. Ten slotte bestond de derde risicogroep uit personen met een verhoogd risico door de blootstelling aan omgevingsfactoren die geassocieerd zijn met schizofreniespectrumstoornissen, bijvoorbeeld cannabisgebruik.
Neuro-imagingonderzoek
Voor de beantwoording van de tweede onderzoeksvraag zetten we de prospectieve observationele multicenterstudie TRIP (Treatment Response in Non-Affective Psychosis) op in 4 centra in Nederland. De deelnemende centra waren: GGZ Rivierduinen, GGZ Delfland, GGZ Noord-Holland-Noord en GGZ inGeest. Bij volwassenen van 18-50 jaar oud die recentelijk een psychose hadden doorgemaakt en bij wie een schizofreniespectrumstoornis was gediagnosticeerd, maakten we 18F-FDOPA-PET-scans in het Amsterdam UMC om de aanmaak van dopamine te bepalen in het striatum en drie striatale subgebieden (associatieve, limbische en sensorimotorische striatum). Daarnaast maakten we NM-MRI-scans om de concentratie van neuromelanine in de substantia nigra te meten. Naast patiënten includeerden we ook gezonde vrijwilligers. De controlegroep werd geworven via sociale media en kwam gemiddeld gezien overeen met de patiëntengroep qua leeftijd, geslacht, rookstatus en opleidingsniveau.
De belangrijkste exclusiecriteria – voor patiënten – waren antipsychoticagebruik langer dan één jaar, eerste psychose langer dan vijf jaar geleden en wilsonbekwaamheid ter zake van het onderzoek. Daarnaast mochten alle deelnemers beperkt drugs gebruikt hebben in het verleden. Alle deelnemers gaven informed consent. Het onderzoek werd goedgekeurd door de medisch-ethische toetsingscommissie (NL72218.058.20) en liep in de periode maart 2019-september 2022.
In beide groepen afzonderlijk correleerden we de gemiddelde aanmaak van striataal dopamine met de neuromelanineconcentratie in de substantia nigra met een voxelwise analyse uitgevoerd in Matlab. Hierbij werd gecorrigeerd voor leeftijd. We herhaalden de analyse voor de striatale subgebieden. De analyses zijn elders in detail beschreven.8
Aangezien men in eerder onderzoek zowel een verhoogde aanmaak van striataal dopamine als een verhoogde neuromelanineconcentratie in de substantia nigra vond bij patiënten met schizofreniespectrumstoornissen, verwachtten we een positief verband te vinden tussen de twee uitkomstmaten in beide groepen.7,10
GROUP-studie
In de toekomst zouden clinici technologische hulpmiddelen kunnen gebruiken die – bijvoorbeeld met informatie over neurobiologische processen – klinische besluitvorming over preventie-/interventiestrategieën kunnen ondersteunen. Met data van de Genetic Risk and Outcome of Psychosis(GROUP)-studie zijn we dieper ingegaan op dit toekomstperspectief. De GROUP-studie is een Nederlands longitudinaal observationeel multicentercohortonderzoek naar genetische en niet-genetische factoren die mogelijk een rol spelen bij de ontwikkeling en het beloop van schizofreniespectrumstoornissen.11 Bijna 1140 patiënten met een schizofreniespectrumstoornis (16-50 jaar oud) deden tussen april 2004 en december 2013 mee aan dit onderzoek. Zij werden geworven via 36 ggz-instellingen en gevolgd gedurende 6 jaar.
Voor onze hoofdanalyse selecteerden we patiënten die tijdens het eerste onderzoeksmoment of een van de vervolgmetingen na 3 en 6 jaar voldeden aan criteria voor therapieresistente of antipsychotica-responsieve schizofrenie. Aangezien behandelrespons niet direct was geëvalueerd tijdens de GROUP-studie, gebruikten we – net als in eerder onderzoek – een proxydefinitie om therapieresistente patiënten te identificeren, namelijk het gebruik van clozapine.12 Patiënten die tijdens de studie > 12,5 mg clozapine hadden gebruikt, definieerden we als de therapieresistente groep. We gebruikten de grenswaarde van 12,5 mg aangezien de Nederlandse richtlijn aanraadt om een behandeling met clozapine voor therapieresistente schizofrenie te starten met minimaal 12,5 mg per dag. Lagere doseringen zijn daarnaast waarschijnlijk voorgeschreven voor andere indicaties. Patiënten die geen clozapine hadden gebruikt, maar wel ten minste één ander antipsychoticum en waarbij scores op items P1, P2, P3, N1, N4, N6, G5 en G9 van de Positive and Negative Syndrome Scale ≤ 3 waren op minstens één van de onderzoeksmomenten, werden ingedeeld in de antipsychotica-responsieve groep.
Aangezien een technologisch hulpmiddel voor het voorspellen van therapierespons eerder ingezet zal worden bij het begin van een medicamenteuze behandeling, wanneer er nog geen tekenen van respons of non-respons zijn, selecteerden we voor een aanvullende analyse alleen patiënten die bij aanvang van de GROUP-studie nog niet voldeden aan de criteria voor therapieresistente of antipsychotica-responsieve schizofrenie, maar op een later meetmoment wel.
Met machinelearningtechnieken (random forest-algoritmes) keken we vervolgens of kenmerken die relatief stabiel zijn over de tijd (ook wel ‘traits’ genoemd) geassocieerd waren met therapieresistente schizofrenie. Voorbeelden van de bestudeerde kenmerken zijn: duur van de onbehandelde psychose, leeftijd bij aanvang van de ziekte, premorbide functioneren en urbaniciteit van de leefomgeving. We evalueerden ten slotte ook hoe goed de modellen waren in het voorspellen van behandelresistentie.
Resultaten
Dopaminesysteem van hoogrisicogroepen
We vonden 63 onderzoeken waarin met PET, SPECT of NM-MRI naar het dopaminesysteem van hoogrisicogroepen werd gekeken tijdens rust, evenals na farmacologische, gedrags- of cognitieve interventies.13 Hieruit bleek dat de beschikbaarheid van de striatale dopamine D2/D3-receptor niet afwijkt – vergeleken met gezonde individuen – bij personen met een hoog risico op een schizofreniespectrumstoornis vanwege klinische, genetische of omgevingsfactoren. Wel vonden we dat de aanmaak van dopamine in het striatum verhoogd was bij sommige individuen met een klinisch of genetisch hoog risico (bijvoorbeeld individuen met 22q11DS) en juist verlaagd was bij personen met een verhoogd risico vanwege cannabisgebruik.
Dopamine en neuromelanine
In totaal includeerden we 18 patiënten met een schizofreniespectrumstoornis en 24 gezonde vrijwilligers.8 Helaas waren de data van 14 deelnemers niet bruikbaar door onder andere beweging tijdens de hersenscans. Voor de uiteindelijke analyse gebruikten we daarom data van 12 patiënten en 16 controlepersonen. Het merendeel was man (respectievelijk 83% en 75% van de patiënten en controlepersonen) en in de 20 (gemiddelde leeftijd patiëntengroep: 20,8 (SD: 2,7); gemiddelde leeftijd controlepersonen: 24,5 (SD: 6,2)). Patiënten hadden op het moment van de hersenscans gemiddeld 122 dagen antipsychotica gebruikt (SD: 98).
Tegen de verwachting in bleek uit ons onderzoek dat bij gezonde vrijwilligers de neuromelanineconcentratie in de substantia nigra significant negatief gecorreleerd was met de aanmaak van dopamine in het gehele striatum (p = 0,033; rho = -0,853) en het limbische striatum (p = 0,005; rho = -0,840). Bij patiënten vonden we geen statistisch significante correlaties tussen beide uitkomstmaten (p’s > 0,05; gehele striatum: rho = 0,110; limbische striatum: rho = 0,077).
Voorspellen van behandelresponse
Uit de machinelearninganalyse bleek dat slecht premorbide functioneren van de patiënt en jongere leeftijd bij aanvang van de schizofreniespectrumstoornis belangrijke voorspellers zijn van therapieresistente schizofrenie. In de subgroep van patiënten die bij aanvang van de GROUP-studie nog niet voldeden aan de criteria voor therapieresistente of antipsychotica-responsieve schizofrenie, maar op een later meetmoment wel, vonden we daarnaast dat slecht premorbide functioneren en een lager opleidingsniveau belangrijk waren voor de voorspelling van therapieresistente schizofrenie. De machinelearningmodellen presteerden echter matig in het voorspellen van therapieresistente schizofrenie.
Discussie
Belangrijkste bevindingen
Allereerst vonden we dat de aanmaak van dopamine in het striatum afwijkt bij sommige personen met een verhoogd risico op het ontstaan van schizofreniespectrumstoornissen vergeleken met controlepersonen. Ook bleek bij gezonde vrijwilligers de aanmaak van striataal dopamine negatief geassocieerd te zijn met de concentratie van neuromelanine in de substantia nigra. Dit vonden we niet bij patiënten met schizofreniespectrumstoornissen. Ten slotte bleek dat slecht premorbide functioneren geassocieerd was met therapieresistente schizofrenie. Voorspellende modellen gebaseerd op deze informatie presteerden echter nog matig in het voorspellen van therapieresistente schizofrenie.
Systematisch literatuuronderzoek
Ons literatuuronderzoek ondersteunt de hypothese dat afwijkingen in het dopaminesysteem al optreden bij sommige personen met een verhoogd risico op een schizofreniespectrumstoornis, voordat zij daadwerkelijk deze stoornis krijgen. In tegenstelling tot onze resultaten vonden Britse auteurs in een meta-analyse geen bewijs voor dergelijke veranderingen bij klinische en genetische hoogrisicogroepen.14 Zij combineerden echter PET-onderzoeken met een verschil in onderzoeksopzet, patiëntengroepen en radiofarmaca. Dit beperkt de interpretatie van hun bevindingen. Bovendien vonden ze net geen statistisch significant verschil in de aanmaak van dopamine in het striatum tussen mensen met een klinisch hoog risico en controlepersonen (p = 0,07). Het is aannemelijk dat personen met een verhoogd risico op het ontstaan van een schizofreniespectrumstoornis verdeeld kunnen worden in meerdere subgroepen. Deze subgroepen verschillen waarschijnlijk in hun risico’s op het ontstaan van een schizofreniespectrumstoornis en in de mate waarin neurobiologische processen afwijken in vergelijking met gezonde individuen. Onze bevindingen suggereren dat informatie over het dopaminesysteem – verkregen met beeldvormende technieken – in de toekomst zou kunnen helpen bij het stratificeren van patiënten, waarna passende preventiestrategieën kunnen worden ingezet.
Neuro-imagingonderzoek
De negatieve correlatie tussen dopamine en neuromelanine bij gezonde vrijwilligers kan mogelijk verklaard worden door het functioneren van de vesiculaire monoaminetransporter-2 (VMAT-2). Deze transporter zorgt ervoor dat dopamine vanuit het cytosol opgeslagen wordt in synaptische blaasjes, waardoor er minder dopamine omgezet kan worden in neuromelanine (figuur 3). Het ontbreken van een correlatie tussen de aanmaak van dopamine in het striatum en neuromelanineconcentratie in de substantia nigra bij patiënten heeft mogelijk te maken met de kleine groepsgrootte en/of de invloed van antipsychotica, ziekteduur en ernst van symptomen op de uitkomstmaten. Vervolgonderzoek gericht op de onderlinge relaties tussen de aanmaak van dopamine, neuromelanineconcentratie, VMAT-2 en andere gerelateerde processen in grotere homogene groepen van patiënten en controlepersonen is dan ook noodzakelijk. Daarnaast is vervolgonderzoek nodig naar de exacte betekenis van het NM-MRI-signaal. Aangezien NM-MRI toegankelijker is dan SPECT/PET zouden in de toekomst mogelijk onderzoekers en clinici daarmee het dopaminesysteem bij mensen efficiënter en tegen lagere kosten kunnen onderzoeken.
Figuur 3. Dopaminesysteem15
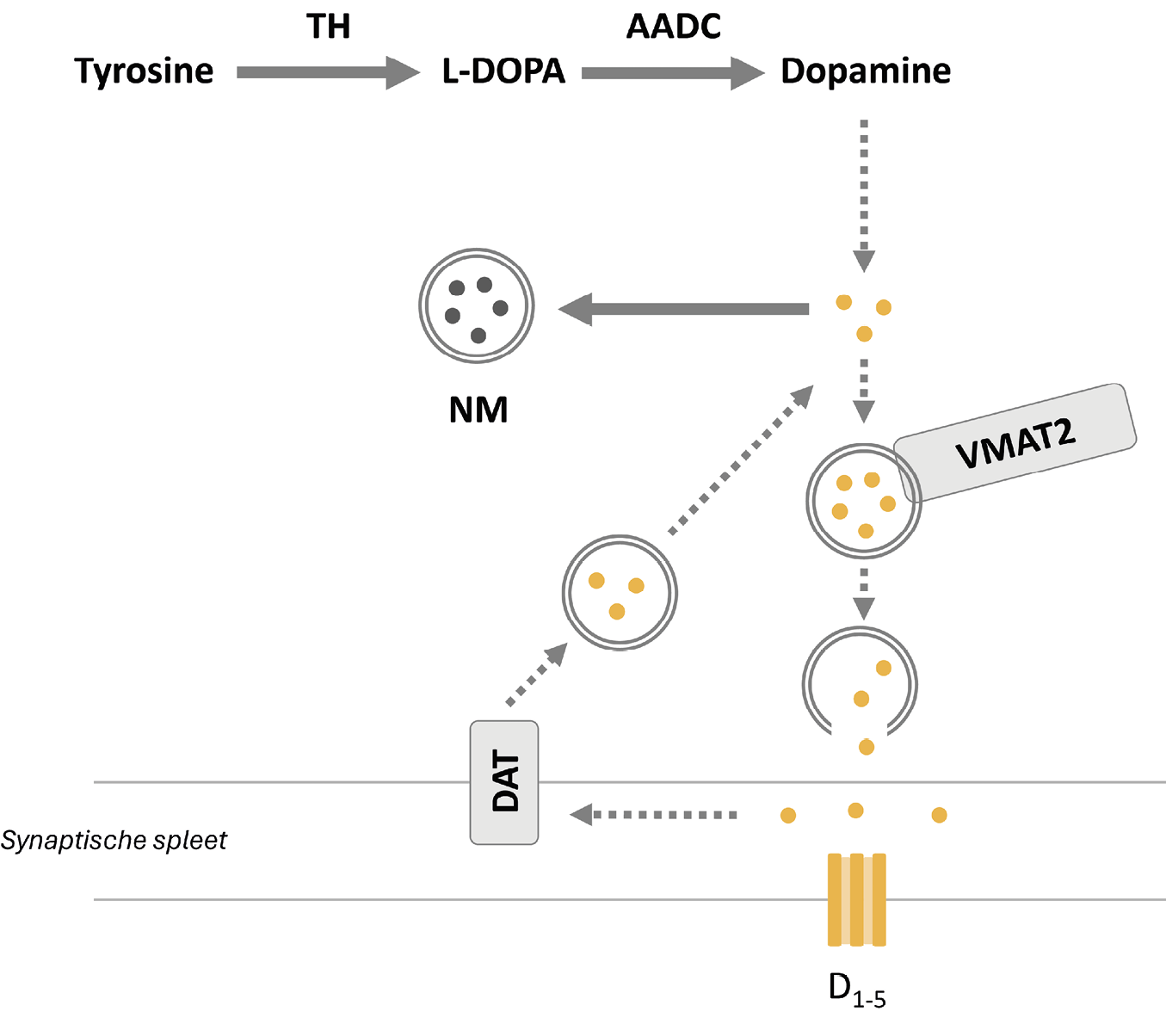
In het presynaptische neuron zet tyrosinehydroxylase (TH) tyrosine om in L-DOPA, dat door aromatisch L-aminozuur-decarboxylase (AADC) omgezet wordt in dopamine. De vesiculaire monoaminetransporter-2 (VMAT-2) vervoert en slaat dopamine op in synaptische blaasjes. Deze kunnen vervolgens afgegeven worden in de synaptische spleet. Na afgifte kan dopamine binden aan dopaminereceptoren (D1-5) op postsynaptische neuronen. De presynaptische dopaminetransporter (DAT) zorgt voor de heropname van dopamine. Overtollig dopamine in het cytosol kan in meerdere stappen worden omgezet naar neuromelanine (NM).15
GROUP-studie
Onze machinelearninganalyses toonden consistent aan dat slecht premorbide functioneren geassocieerd is met therapieresistente schizofrenie. Dit komt overeen met eerdere bevindingen uit observationele studies.16,17 Helaas ook vergelijkbaar met eerdere studies presteerden onze machinelearningmodellen – gebaseerd op klinische, familiaire, sociodemografische en omgevingsfactoren – matig in het voorspellen van therapieresistente schizofrenie. De modellen hadden over het algemeen een hoge specificiteit en lage sensitiviteit, oftewel: ze waren goed in het herkennen van antipsychotica-responsieve patiënten, maar niet zo goed in het herkennen van therapieresistente patiënten. Vervolgonderzoek is daarom nodig om te bepalen hoe de prestatie van de modellen verbeterd kan worden en welke aanvullende informatie hiervoor nodig is, bijvoorbeeld informatie verkregen via beeldvormende technieken. Hierbij is het ook belangrijk dat de modellen getest worden in aanvullende datasets om te kijken of ze dan nog even goed werken.
Implicaties en toekomstig onderzoek
Op basis van de resultaten beschreven in het proefschrift benadrukken we de volgende implicaties voor de praktijk. Ten eerste: hersenscans kunnen mogelijk in de toekomst binnen de ggz niet alleen gebruikt worden voor het uitsluiten van lichamelijke oorzaken van psychiatrische stoornissen (zoals hersentumoren), maar ook ingezet worden voor andere doeleinden. Zo zouden behandelaren er in de toekomst mogelijk voor kunnen kiezen om een hersenscan te laten maken bij patiënten bij wie na vier à zes weken behandeling met eerstelijnsantipsychotica geen of weinig verbetering zichtbaar is. Deze scan zou bepaalde neurochemische processen, zoals neuromelanine, in kaart kunnen brengen. De behandelaar zou deze informatie vervolgens kunnen gebruiken om de patiënt eerder te adviseren over te stappen naar een alternatieve behandeling (zoals clozapine) in plaats van het doorlopen van de gehele medicamenteuze behandelrichtlijn. Toekomstige grotere onderzoeken zijn nodig om te bepalen welke beeldvormende technieken ingezet kunnen worden voor welke vraagstelling en voor welke doelgroep.
Ten tweede: technologische hulpmiddelen kunnen mogelijk waardevol zijn voor het ondersteunen van klinische besluitvorming. Dergelijke instrumenten worden al gebruikt binnen de Nederlandse ggz, bijvoorbeeld voor het identificeren van patiënten met een depressieve stoornis met een hoogspecialistische zorgvraag.18 Technologische hulpmiddelen worden echter nog niet gebruikt voor het selecteren van preventie-/interventiestrategieën bij psychotische en aanverwante stoornissen.
Om technologische hulpmiddelen te kunnen ontwikkelen is het belangrijk om grote hoeveelheden data te verzamelen en te combineren in databanken. Deze databanken kunnen gebruikt worden om machinelearningmodellen te ontwikkelen die kunnen herkennen welke kenmerken (bijvoorbeeld leeftijd bij aanvang van de schizofreniespectrumstoornis) geassocieerd zijn met een bepaalde uitkomst (bijvoorbeeld therapieresistente schizofrenie). Deze modellen kunnen vervolgens gebruikt worden om de uitkomst van preventie- en interventiestrategieën bij nieuwe patiënten te voorspellen. Onderzoekers van King’s College Londen hebben onlangs een databank gemaakt met 18F-FDOPA-PET-scans en klinische en sociodemografische gegevens van 597 patiënten met een schizofreniespectrumstoornis en 195 controlepersonen.19 Meer van dit soort initiatieven en het combineren van kennis uit verschillende centra zijn nodig, zodat we in toekomstige studies kunnen bepalen welke informatie nodig is voor welke vraagstelling en voor welke doelgroep.
Ten derde: als iemand in zorg komt bij een ggz-instelling, wordt er een diagnostisch proces gestart dat onder andere een DSM-5-classificatie moet opleveren. Op basis van doelen en wensen van de patiënt of, in het geval van wilsonbekwaamheid, zijn of haar wettelijke vertegenwoordiger, en gelet op de beschrijvende diagnose en een DSM-5-classificatie, wordt een behandelstrategie gekozen. Patiënten met dezelfde DSM-5-classificatie kunnen echter erg verschillen in de wijze waarop ze reageren op antipsychotica. In de toekomst zou het daarom mogelijk efficiënter zijn om patiënten ook te categoriseren op basis van de behandeling waarop ze waarschijnlijk zullen reageren (bijvoorbeeld clozapine-responsieve schizofrenie) naast het type schizofreniespectrumstoornis (schizofrenie of schizoaffectieve stoornis). Dit zou clinici wellicht in staat stellen om patiënten sneller een effectieve medicamenteuze behandeling te bieden.
Beperkingen
Een belangrijke beperking van dit proefschrift is dat vanwege de complexiteit van de procedures en de moeilijkheid bij het werven van patiënten, de steekproefomvang van meerdere onderzoeken relatief klein is. Dit komt ook doordat veel patiënten met een schizofreniespectrumstoornis hard- en/of softdrugs gebruiken. Aangezien de effecten van middelengebruik op de hersenen nog onduidelijk zijn, mochten personen met overmatig middelengebruik niet meedoen aan de verschillende onderzoeken. Bovendien konden alleen personen meedoen die wilsbekwaam waren ter zake van het onderzoek. Dit houdt in dat de proefpersoon het doel van het onderzoek en de bijbehorende voordelen, nadelen en risico’s moet begrijpen. Deze beperkingen hebben mogelijk gezorgd voor een selectiebias (waarschijnlijk hebben voornamelijk goed functionerende patiënten meegedaan aan de onderzoeken), wat de generaliseerbaarheid van onze bevindingen kan beperken.
Ten slotte, de onderzoeken die we hebben uitgevoerd, zijn allemaal crosssectioneel van aard, oftewel: de onderzoeken zijn op één moment uitgevoerd. Hierdoor hebben we alleen associaties tussen verschillende concepten kunnen onderzoeken en geen causale verbanden of veranderingen over de tijd.
Conclusie
Dit proefschrift heeft nieuwe inzichten opgeleverd over neurochemische processen bij patiënten met schizofreniespectrumstoornissen en personen met een verhoogd risico op het ontstaan van deze aandoeningen. Informatie over neurochemische processen – verkregen met beeldvormende technieken – zou in de toekomst mogelijk gebruikt kunnen worden om klinische besluitvorming over preventie-/interventiestrategieën te ondersteunen. Dit zou kunnen leiden tot de ontwikkeling van gepersonaliseerde medicamenteuze behandelingen voor psychose en aanverwante stoornissen.
Noot
Dit artikel is gebaseerd op het proefschrift van de eerste auteur ‘On the bumpy road of psychotic disorders: Paving new avenues for personalized treatment approaches by examining neurochemical changes in psychosis and related disorders’ (www.globalacademicpress.com/ebooks/carmen_van_hooijdonk).
Literatuur
1 Jonas RK, Montojo CA, Bearden CE. The 22q11.2 deletion syndrome as a window into complex neuropsychiatric disorders over the lifespan. Biol Psychiatry 2014; 75: 351-60.
2 Bassett AS, McDonald-McGinn DM, Devriendt K, e.a. Practical guidelines for managing patients with 22q11.2 deletion syndrome. J Pediatr 2011; 159: 332-9.
3 Schneider M, Debbané M, Bassett AS, e.a. Psychiatric disorders from childhood to adulthood in 22q11.2 deletion syndrome: results from the International Consortium on Brain and Behavior in 22q11.2 Deletion Syndrome. Am J Psychiatry 2014; 171: 627-39.
4 Siskind D, Orr S, Sinha S, e.a. Rates of treatment-resistant schizophrenia from first-episode cohorts: systematic review and meta-analysis. Br J Psychiatry 2022; 220: 115-20.
5 Letai A, Bhola P, Welm AL. Functional precision oncology: testing tumors with drugs to identify vulnerabilities and novel combinations. Cancer Cell 2022; 40: 26-35.
6 Blucher AS, Mills GB, Tsang YH. Precision oncology for breast cancer through clinical trials. Clin Exp Metastasis 2022; 39: 71-8.
7 Brugger SP, Angelescu I, Abi-Dargham A, e.a. Heterogeneity of striatal dopamine function in schizophrenia: meta-analysis of variance. Biol Psychiatry 2020; 87: 215-24.
8 van Hooijdonk CFM, van der Pluijm M, Smith C, e.a. Striatal dopamine synthesis capacity and neuromelanin in the substantia nigra: A multimodal imaging study in schizophrenia and healthy controls. Neuroscience Applied 2023; 101134.
9 Sasaki M, Shibata E, Tohyama K, e.a. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson’s disease. Neuroreport 2006; 17: 1215-8.
10 Wieland L, Fromm S, Hetzer S, e.a. Neuromelanin-sensitive magnetic resonance imaging in schizophrenia: a meta-analysis of case-control studies. Front Psychiatry 2021; 12: 770282.
11 Korver N, Quee PJ, Boos HB, e.a. Genetic Risk and Outcome of Psychosis (GROUP), a multi-site longitudinal cohort study focused on gene–environment interaction: objectives, sample characteristics, recruitment and assessment methods. Int J Methods Psychiatr Res 2012; 21: 205-21.
12 Wimberley T, Støvring H, Sørensen HJ, e.a. Predictors of treatment resistance in patients with schizophrenia: a population-based cohort study. Lancet Psychiatry 2016; 3: 358-66.
13 van Hooijdonk CFM, Drukker M, van de Giessen E, e.a. Dopaminergic alterations in populations at increased risk for psychosis: A systematic review of imaging findings. Prog Neurobiol 2022; 213: 102265.
14 McCutcheon RA, Merritt K, Howes OD. Dopamine and glutamate in individuals at high risk for psychosis: a meta‐analysis of in vivo imaging findings and their variability compared to controls. World Psychiatry 2021; 20: 405-16.
15 van Hooijdonk CFM, van der Pluijm M, Bosch I, e.a. The substantia nigra in the pathology of schizophrenia: A review on post-mortem and molecular imaging findings. Eur Neuropsychopharmacol 2023; 68: 57-77.
16 Chan SKW, Chan HYV, Honer WG, e.a. Predictors of treatment-resistant and clozapine-resistant schizophrenia: a 12-year follow-up study of first-episode schizophrenia-spectrum disorders. Schizophr Bull 2021; 47: 485-94.
17 Chan SKW, Chan WY, Hui CLM, e.a. Predictors of treatment resistant schizophrenia-spectrum disorder: 10-year retrospective study of first-episode psychosis. Early Interv Psychiatry 2014; 8: 78.
18 van Krugten FC, Goorden M, van Balkom AJ, e.a. The decision tool unipolar depression (DTUD): a new measure to facilitate the early identification of patients with major depressive disorder in need of highly specialized care. BMC Psychiatry 2019; 19: 1-9.
19 Nordio G, Easmin R, Giacomel A, e.a. Digital data repository and automatic analysis framework for FDOPA PET neuroimaging. (preprint.) bioRxiv 2022: 14.488129.
Authors
Carmen van Hooijdonk, postdoconderzoeker, Universiteit Maastricht en wetenschapsredacteur.
Jan Booij, nucleair geneeskundige, Amsterdam UMC en hoogleraar Experimentele nucleaire geneeskunde, Universiteit van Amsterdam.
Elsmarieke van de Giessen, radioloog, Amsterdam UMC en postdoconderzoeker, Amsterdam UMC.
Jean-Paul Selten, psychiater en emeritus hoogleraar Sociale uitsluiting en psychische stoornissen, Universiteit Maastricht.
Thérèse van Amelsvoort, psychiater MUMC, Mondriaan, Koraal en hoogleraar Transitiepsychiatrie, Universiteit Maastricht.
Correspondentie
Dr. Carmen van Hooijdonk
(carmen.vanhooijdonk@maastrichtuniversity.nl).
Strijdige belangen: Van der Giessen meldde grants van ZonMw, Hersenstichting, KWF, Roche en Heuron Inc. en honoraria voor consulten van Ixico; Booij meldde grants van ZonMw, Heuron Inc. en Ixico, en honoraria als auteur van GE Healthcare; Van Amelsvoort meldde grants van Stanford University, FNO en Boehringer Ingelheim.
Het artikel werd voor publicatie geaccepteerd op 23-01-2024.
Citeren
Tijdschr Psychiatr. 2024;66(7):308-315
