The usefulness of therapeutic drug monitoring during treatment with second-generation antidepressants
Background Although there is clear evidence that therapeutic drug monitoring (TDM) has beneficial effects for patients treated with tricyclic antidepressants, it is generally not recommended for second-generation antidepressants (SGA). However, it has been suggested that methodological shortcomings might influence the results in TDM studies with SGA.
Aim A qualitative assessment of randomized controlled trials (RCTs) that specifically investigated drug concentration-effect relationships of SGA in patients with major depressive disorder (MDD) to analyze the potential benefit of TDM during treatment with these agents.
Method A literature search, using the PubMed, Embase, and Cochrane CENTRAL databases, was conducted for RCTs. A research protocol was used to make a quality assessment.
Results A total of 15 studies were included. Evidence for the existence of a drug concentration-effect relationship during the administration of SGA in adult patients with MDD is virtually non-existent. The argument that methodological shortcomings might influence the results in TDM studies with SGA is weak.
Conclusion There is little evidence that methodological shortcomings of studies would influence the results in TDM studies with SGA. This does not mean that TDM during treatment with SGA cannot be useful in specific situations.
Door de groeiende belangstelling voor precisiegeneeskunde lijkt er voor therapeutische drugmonitoring (TDM) een steeds belangrijkere rol te zijn weggelegd.1 Ten gevolge van grote interindividuele verschillen in de absorptie, distributie, metabolisatie en excretie van geneesmiddelen, kan eenzelfde dosis van een bepaald geneesmiddel leiden tot een meer dan 20-voudige variatie in de steady-stateconcentratie van het middel.2,3 Door gebruik te maken van TDM kan men de dosering van geneesmiddelen afstellen op de aanwezige concentraties van het middel in het bloed zodat een behandeling toegediend kan worden die de hoogste waarschijnlijkheid geeft op een klinische respons met een laag risico op neveneffecten.3-6 Bij deze techniek wordt de bloedspiegel namelijk vergeleken met het therapeutisch referentiebereik van het geneesmiddel. Deze laatste specificeert enerzijds een drempelwaarde waaronder een klinische respons relatief gezien onwaarschijnlijk wordt of niet significant verschilt van placebo (de subtherapeutische spiegel), en anderzijds een grenswaarde waarboven de tolerantie voor het middel, onder meer door bijwerkingen, vermindert en het relatief gezien onwaarschijnlijk wordt dat een verdere therapeutische verbetering kan worden bewerkstelligd (de supratherapeutische spiegel) (zie figuur 1).3
Figuur 1. Geneesmiddelconcentraties in het bloed in functie van de tijd na toediening van orale medicatie3
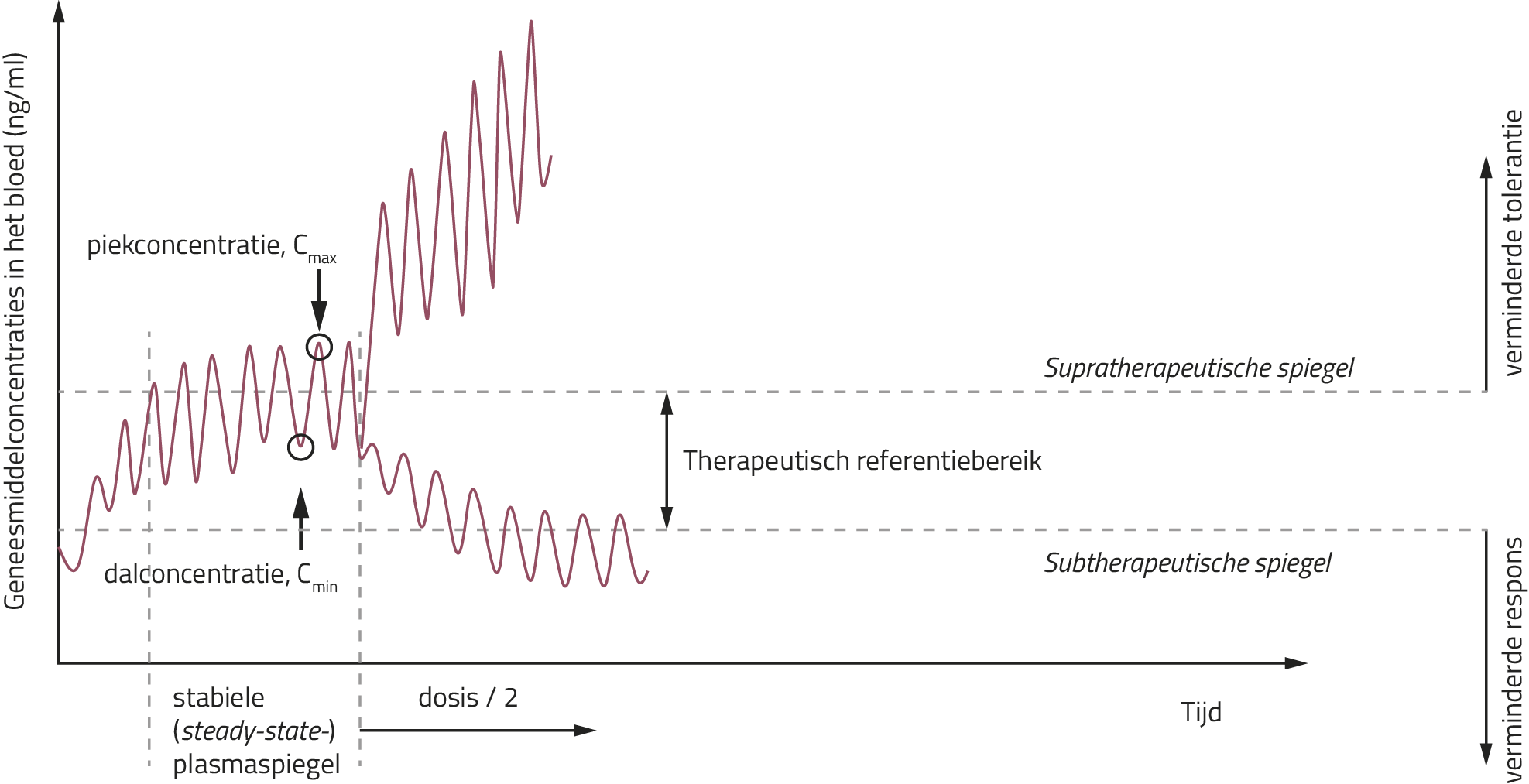
TDM is vooral van meerwaarde bij geneesmiddelen met een duidelijk aangetoonde relatie tussen geneesmiddelconcentraties en klinisch effect en/of bijwerkingen, een onvoorspelbare farmacokinetiek (niet-lineaire farmacokinetiek bij dosisverhoging of grote inter- en intra-individuele variabiliteit, leidend tot ‘pseudoresistentie’)7 of een nauw therapeutisch venster (d.w.z. geneesmiddelen waarbij het verschil tussen een net effectieve dosering en een toxische dosering klein is). Daarnaast kan TDM o.a. ook aangewend worden bij een vermoeden van een gebrekkige therapietrouw, zwangerschap, of bij specifieke patiëntengroepen (kinderen en oudere volwassenen).3-5
Richtlijnen over antidepressiva, zoals de in 2018 in World Journal of Biological Psychiatry gepubliceerde richtlijn, bevelen het gebruik van TDM bij de toediening van tricyclische antidepressiva (TCA) aan, dit wegens de grote klinische waarde die het gebruik van deze techniek heeft tijdens de toediening van deze middelen. TCA hebben namelijk een relatief nauw therapeutisch venster en de relatie tussen plasmaspiegel en therapeutisch effect werd voor de meeste TCA aangetoond.4,5,8 Dezelfde richtlijnen raden TDM evenwel niet als standaardpraktijk aan tijdens een behandeling met moderne antidepressiva, d.w.z. antidepressiva die niet tot de groep van TCA of monoamineoxidaseremmers (MAO-remmers) behoren, waaronder de selectieve serotonineheropnameremmers, (SSRI’s), de selectieve serotonine-en-noradrenaline-heropnameremmers (SNRI’s), en de noradrenaline- en dopamine-heropnameremmers zoals bupropion. De reden hiervan is dat er voor deze middelen beperkte evidentie is voor het bestaan van een verband tussen geneesmiddelconcentraties in het plasma of in het bloed en de klinische effecten van het middel. Diverse auteurs stellen evenwel dat bepaalde methodologische tekortkomingen van de beschikbare studies een verklaring zouden kunnen bieden voor de niet-consistente resultaten die gevonden worden omtrent het gebruik van TDM bij moderne antidepressiva.2,3,9,10
Tot voor kort bestonden er geen gestandaardiseerde schalen voor de kwaliteitsbeoordeling van studies die specifiek het verband tussen geneesmiddelconcentraties in het bloed en de therapeutische effecten van het middel onderzoeken. In 2021 publiceerden Hart e.a. een onderzoeksprotocol dat een hulpmiddel biedt om gepubliceerde TDM-studies te beoordelen op hun kwaliteit.1 In deze systematische overzichtsstudie willen we daarom aan de hand van dit protocol een kwaliteitsbeoordeling maken van gepubliceerde gerandomiseerde en gecontroleerde studies (RCT’s) die specifiek geneesmiddelconcentratie-effectrelaties van moderne antidepressiva onderzoeken bij volwassen patiënten met een depressieve stoornis. Op basis hiervan willen we een antwoord trachten te vinden op de vraag naar het eventuele nut van TDM tijdens een behandeling met moderne antidepressiva bij deze patiëntenpopulatie.
Methode
Zoekmethode en in- en exclusiecriteria
We voerden een literatuuronderzoek uit (tot maart 2023) via PubMed, Embase en Cochrane CENTRAL naar peer-reviewed studies die informatie verschaffen over de geneesmiddelconcentratie-effectrelatie (werkzaamheid en/of verdraagzaamheid) van moderne antidepressiva bij volwassen patiënten met een depressieve stoornis (d.w.z. patiënten tussen 18 en 65 jaar, zonder relevante farmacokinetische comorbiditeit, of genetische afwijkingen in de metabolisatie van geneesmiddelen). De literatuurstudie gebeurde aan de hand van diverse zoekstrings waarin combinaties en variaties werden gebruikt van indextermen (MESH-termen, waaronder ‘Drug Monitoring’ en ‘Antidepressive Agents, Second-Generation’, en EMTREE-termen, waaronder ‘drug monitoring’ en ‘antidepressant agent’) en tekstwoorden (zoals ‘drug concentration*’, ‘blood level*’, ‘serum level*’, ‘second-generation antidepress*’, en ‘atypical antidepress*’) (de volledige zoekstrings kunnen opgevraagd worden bij de corresponderende auteur). Aanvullend maakten we gebruik van referenties uit de geselecteerde studies en bestaande overzichtsstudies om bijkomende gegevens te verzamelen. Deze studie werd uitgevoerd overeenkomstig de PRISMA-aanbevelingen voor systematische overzichtsstudies.14
Studies werden geïncludeerd indien:
– het ging om een gerandomiseerd en gecontroleerd onderzoek (met het verzamelen van farmacokinetische gegevens aan de hand van dit onderzoeksdesign vermijdt men de bias van patiëntenselectie die binnen een naturalistische TDM-setting kan voorkomen);
– de studiepopulatie voor ten minste 80% bestond uit volwassen patiënten (18-65 jaar) met een depressieve stoornis, vastgesteld aan de hand van een diagnostisch classificatiesysteem en/of structureel diagnostisch interview;
– de studies gegevens omtrent de relatie tussen geneesmiddelconcentraties en werkzaamheid en/of neveneffecten tijdens de behandeling met een moderne antidepressiva vermeldden;
Studies werden geëxcludeerd indien de studiepopulatie bestond uit kinderen of adolescenten, oudere volwassenen (gemiddelde leeftijd > 65 jaar), zwangere vrouwen, patiënten met een ernstige medische conditie (bijv. chronisch nierfalen), of patiënten met een therapieresistente depressie, depressie met psychotische kenmerken, of bipolaire stoornis. Ook casusstudies, artikelen die niet peer-reviewed zijn of samenvattingen van conferenties werden geëxcludeerd.
Kwaliteitsbeoordeling
Om de mogelijke invloed van studiekenmerken op de gevonden resultaten van de geïncludeerde studies te onderzoeken, werden deze aan een kwaliteitsbeoordeling onderworpen. Deze beoordeling gebeurde aan de hand van 13 criteria die aanbevolen werden in een recent gepubliceerd protocol voor systematische overzichtsstudies om gevalideerde therapeutische referentiebereiken voor geneesmiddelen op te stellen.1 Deze criteria verwijzen naar de studieopzet, de gebruikte instrumenten voor het bepalen van geneesmiddelconcentraties en uitkomstmaten, en het gebruik van comedicatie (zie ook tabel 1 in de bijlage voor een overzicht van deze kenmerken).
Zo moet de gebruikte analytische methode om geneesmiddelconcentraties in het bloed te meten nauwkeurig, selectief, gevoelig, reproduceerbaar en stabiel zijn.1 Gecombineerde (ultra)-high-performancevloeistofchromatografie- en massaspectrometrietechnieken hebben een hoge specificiteit en detectiegevoeligheid. Een chromatografische immuniteitstest wordt als minder specifiek beschouwd. De hogere sensitiviteit van eerstgenoemde analysemethoden moet het mogelijk maken om geneesmiddelconcentraties onder de ondergrens (d.w.z. de subtherapeutische spiegel) van therapeutische referentiebereiken te meten.1,3
Om klinische bias te voorkomen zouden er tijdens de studieperiode geen medicijnen ingenomen mogen worden die zouden kunnen interfereren met het metabolisme van het onderzochte antidepressivum. Als dit het geval is of als de studie geen gedetailleerde informatie over comedicatie of een subanalyse/correctie vermeld, dient het onderzoek als onvoldoende te worden beoordeeld. Ook zou er een placebowash-out- of -run-infase bij het begin van de studie moeten worden voorzien om al voor het opstarten van de behandeling met het antidepressivum patiënten die positief reageren op een placebobehandeling te verwijderen (hetgeen vooral bij mensen met een lichte depressieve stoornis het geval zou zijn).1
Het gebruik van een vaste dosering tijdens de studieperiode wordt algemeen beschouwd als de beste manier om de relatie tussen geneesmiddelconcentraties van een middel en het klinische effect ervan te beschrijven. Het geven van hogere doseringen bij patiënten die niet reageren op de behandeling en van lagere doseringen bij het optreden van bijwerkingen in studies waarbij gebruikgemaakt wordt van een flexibele dosering, kan namelijk op een artificiële wijze leiden tot negatieve correlaties tussen geneesmiddelconcentraties van een middel en de klinische effecten ervan.1
Het is ook belangrijk dat het onderzoek voldoende informatie verstrekt over het tijdstip waarop bloedmonsters genomen worden omdat dit de concentraties van het antidepressivum in het bloed kan beïnvloeden (in het bijzonder bij middelen met een korte eliminatiehalfwaardetijd, T1/2el). Deze bepaling gebeurt bij voorkeur tijdens het bereiken van een stabiele (steady-state)plasmaspiegel, d.w.z. wanneer de dagelijks geabsorbeerde fractie van de dosis gelijk is aan de dagelijks geëlimineerde hoeveelheid (zie figuur 1).1,3 Praktisch gezien wordt dit plateau bereikt na ongeveer 4 tot 5 maal de T1/2el van het geneesmiddel. Voor meer dan 90% van de psychofarmaca gebeurt dit binnen één week van toediening van de onderhoudsdosis. Over het algemeen zijn monsters van steady-statedalconcentraties (Cmin) (zie figuur 1) aangewezen omdat TDM bij het optimaliseren van farmacotherapie zich gewoonlijk baseert op minimale geneesmiddelconcentraties. Het nemen van bloedmonsters vóór de steady state is bereikt, kan resulteren in een onderschatting van de klinische werkzaamheid van het middel (en bijgevolg in overdosering bij de patiënt).1,3,5
Ten slotte dient de studie een voldoende breed bereik van geneesmiddelconcentraties te presenteren, die ook gegevens omvat van sub- en/of supratherapeutische geneesmiddelconcentraties (zie figuur 1), om tot een representatieve verdeling van geneesmiddelconcentraties te komen.1
Resultaten
Van de 3211 artikelen, geïdentificeerd na het doorzoeken van de databases, werden er, na verwijdering van duplicaten (n = 846) en irrelevante artikelen (n = 2233), 132 geselecteerd die gingen over TDM van moderne antidepressiva. Hiervan werden uiteindelijk 14 studies geïncludeerd. Een bijkomende studie werd geïdentificeerd na het doorzoeken van referentielijsten, hetgeen het totaal aantal geïncludeerde studies op 15 brengt11-25 (zie figuur 2 voor het stroomdiagram).
Figuur 2. PRISMA-stroomdiagram van systematische analyse
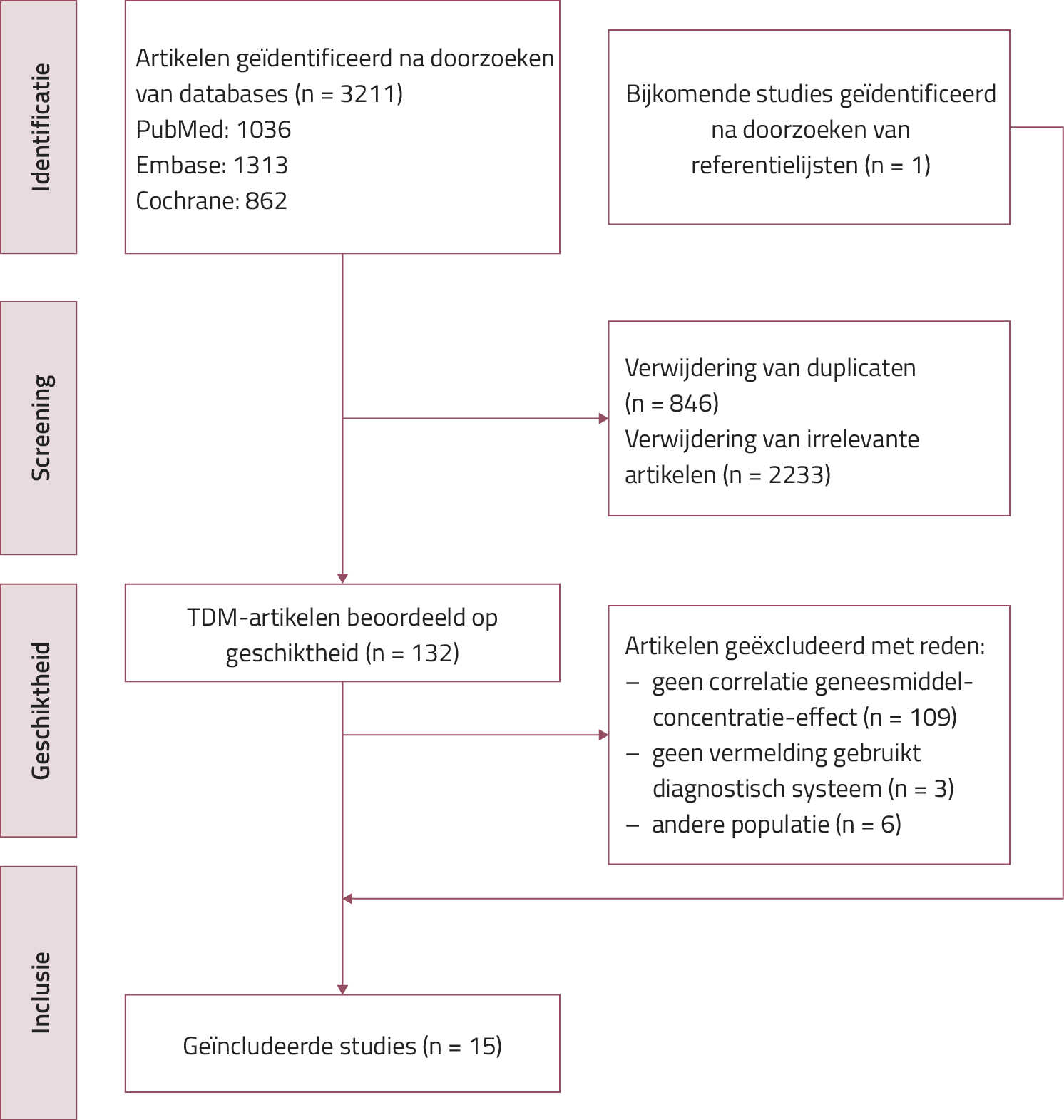
Er is slechts een beperkt aantal RCT’s over het gebruik van TDM met moderne antidepressiva bij volwassen patiënten met een depressieve stoornis gepubliceerd. Bij de meeste van deze studies maakte men gebruik van een actieve controlegroep (n = 13), gevolgd door studies met een placebogroep (n = 1) en een dosistitratiegroep (n = 2). Studies betroffen de SSRI’s citalopram, escitalopram, fluoxetine, fluvoxamine, paroxetine, sertraline, en de SNRI venlafaxine. Geen enkele studie over de antidepressiva trazodon, bupropion en mirtazapine beantwoordde aan de inclusiecriteria. De samenvattende informatie over de kwaliteitsbeoordeling van de diverse geïncludeerde studies is opgenomen in tabel 1.
Bijna in alle studies rapporteerde men dat er geen relatie gevonden werd tussen de geneesmiddelconcentraties in het bloed en de klinische effecten van het middel. De criteria die in de meeste gevallen als onvoldoende werden beoordeeld, waren ‘placebowash-out of -run-in bij het begin van de behandeling’/‘verwijdering van patiënten die positief reageren op een placebobehandeling na vooraf gedefinieerde responscriteria’ (slechts één derde van de studies voldeed aan deze beide criteria), en ‘rapportering van steady-stateconcentratie’ (in slechts de helft van de studies rapporteerde men steady-stateconcentraties). De criteria ‘gebruik van een vast doseringsschema’, ‘rapportering van tijdstippen van bloedafname en inname van antidepressiva’, en ‘rapportering van lage waarden uit het therapeutisch referentiebereik’ waren afwezig in één derde van de studies. Het gebruik van gestructureerde vragenlijsten en gevalideerde analytische methoden, alsook het controleren voor de gebruikte comedicatie konden over het algemeen als voldoende worden beschouwd. De kwaliteitsbeoordeling van studies die na het jaar 2000 werden uitgevoerd (de geïncludeerde studies werden uitgevoerd tussen 1983 en 2016) blijkt niet steeds positiever uit te vallen dan die van studies die voor de eeuwwisseling uitgevoerd werden.
Discussie
Evidentie voor het bestaan van een geneesmiddelconcentratie-effectrelatie tijdens de toediening van moderne antidepressiva bij volwassen patiënten met een depressieve stoornis is zo goed als niet-bestaand. Dit staat in schril contrast met de evidentie voor de klinische waarde van TDM tijdens het gebruik van TCA die gebaseerd is op een veel groter aantal beschikbare studies.2 Het door sommige auteurs2,3,9,10 geopperde argument dat methodologische tekortkomingen van studies met moderne antidepressiva verantwoordelijk zouden zijn voor het gebrek aan vastgestelde verbanden in deze studies lijkt niet op te gaan. In studies met TCA worden namelijk dezelfde methodologische tekortkomingen vastgesteld als in studies met moderne antidepressiva.
Tekortkomingen in TCA-studies
Zo blijkt uit een meta-analyse dat in TCA-studies, waarbij vaak wel een verband wordt vastgesteld tussen geneesmiddelconcentraties in het bloed en de klinische effecten van het middel, tevens in slechts één derde van de gevallen sprake is van een ‘placebowash-out of -run-in bij het begin van de behandeling’ of een ‘verwijdering van patiënten die positief reageren op een placebobehandeling’.2 Verder blijkt dat men ook in ongeveer de helft van deze studies geen steady-stateconcentraties rapporteert. Een van de belangrijkste modererende variabelen in de relatie tussen geneesmiddelconcentraties en klinische effecten die in deze meta-analyse werden geïdentificeerd, was het gebruikte doseringsschema (vast vs. flexibel). De tegengestelde effecten in vaste en flexibele doseringsstudies die bij de genoemde meta-analyse in een subgroepanalyse werden vastgesteld, levert volgens de auteurs een sterke ondersteuning voor de hypothese dat de vaststelling van een invers verband tussen plasmaconcentraties en klinisch effect in flexibele doseringsstudies het gevolg zou kunnen zijn van een hogere dosering bij niet-responders en een lagere dosering bij het optreden van bijwerkingen.2
Tijdens effectiviteitsstudies wordt vaak gebruikgemaakt van flexibele dosering om de effectiviteit van een antidepressivum t.o.v. placebo of een actieve vergelijkingsstof te bewijzen. Door het doseringsschema aan te passen in het geval van een gebrekkige respons of het optreden van bijwerkingen kan de werkzaamheid van antidepressiva worden versterkt in vergelijking met de controlegroepen. Echter, een betekenisvolle relatie tussen geneesmiddelconcentraties en werkzaamheid kan worden verdoezeld door dit type van onderzoeksopzet, aangezien een dergelijke studieopzet mogelijk kan leiden tot het vaststellen van een invers verband tussen geneesmiddelconcentraties en werkzaamheid. Placeboresponders blijven op een lage dosis staan, geassocieerd met lage geneesmiddelconcentraties. Patiënten die niet reageren op een depressieve behandeling zullen daarentegen hogere doses krijgen, geassocieerd met hogere geneesmiddelconcentraties, om een maximaal geneesmiddeleffect te krijgen.10
Een belangrijke opmerking over de genoemde meta-analyse is dat deze zelf behept is met methodologische tekortkomingen.2 De auteurs van deze analyse beperkten zich namelijk voor de selectie van relevante RCT’s tot PubMed en Web of Science. In onze systematische overzichtsstudie gebruikten we echter ook andere essentiële databanken (met name Embase, die in tegenstelling tot PubMed meer Europese tijdschriften en farmacologische artikelen omvat, en Cochrane CENTRAL, de meest omvangrijke bron van RCT’s). Een belangrijke methodologische beperking die in onze systematische overzichtsstudie vastgesteld werd, was dat de geïncludeerde studies ofwel (in de meeste gevallen) uitsluitend patiënten met een chronische depressie, ofwel (in een minderheid van de gevallen) een mix van patiënten met een chronische en eerste episode van een depressie omvatten. Aangezien onderzoek heeft aangetoond dat een groter aantal depressieve periodes een voorspellende factor is voor behandelingsresistente depressie/verminderde remissie, kunnen de vaststellingen van deze overzichtsstudie niet uitgebreid worden tot de volledige populatie van patiënten met een depressieve stoornis.
Praktische toepassing therapeutische drugmonitoring
Als gevolg van grote interindividuele verschillen in geneesmiddelconcentraties in het bloed en een gebrek aan evidentie voor het bestaan van een dosis-responsrelatie, wordt de systematische monitoring van bloedspiegels voor SSRI’s nauwelijks toegepast.26 Een mogelijke verklaring hiervoor is het vastgestelde plafondeffect voor SSRI’s: een minimale effectieve dosis leidt al tot ongeveer 80% van de serotonineheropnameremming, met verder weinig additioneel effect bij hogere doseringen.26,27 Dit neemt niet weg dat TDM tijdens de toediening van SSRI’s van belang kan zijn voor een aantal specifieke patiëntengroepen (bijv. kinderen, oudere volwassenen, patiënten met nier- en/of leverfunctiestoornissen of zwangere vrouwen) of in diverse specifieke situaties. Zo kan TDM tijdens het gebruik van SSRI’s waardevol zijn om geneesmiddelconcentraties in het bloed te bepalen bij een vermoeden van een gebrekkige therapietrouw of relevante farmacokinetische factoren (ultrasnelle of trage metabolisatie van het cytochroomenzymsysteem of interfererende comedicatie).
Diverse studies hebben bijvoorbeeld aangetoond dat TDM in de klinische praktijk nuttig kan zijn tijdens het gebruik van escitalopram, vooral om patiënten met een ultrasnelle of trage metabolisatie van het cytochroomenzymsysteem of patiënten met een gebrekkige therapietrouw op te sporen.28,29 Een andere klinische toepassing voor het gebruik van TDM bij toediening van moderne antidepressiva zou kunnen zijn het zich verzekeren van therapeutische spiegelwaarden bij behandelingsresistente patiënten of het zo spoedig mogelijk bereiken van therapeutische spiegelwaarden bij patiënten met suïcidale gedachten.29,30
De kosten die gepaard gaan met TDM moeten wel steeds afgewogen worden tegenover het klinisch voordeel dat zou worden verkregen wanneer TDM wordt toegepast. TDM tijdens het gebruik van moderne antidepressiva moet dus beperkt worden tot situaties waarbij verwacht mag worden dat het resultaat van de TDM het therapeutisch probleem helpt oplossen.28
Belang van genotypering
Genotypering kan ook een belangrijke plaats innemen binnen TDM van moderne antidepressiva. Zo wordt in de ‘leidraad farmacogenetica voor de dagelijkse psychiatrische praktijk’, die in opdracht van de Nederlandse Vereniging voor Psychiatrie opgesteld werd door een werkgroep met daarin enkele leden van de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), genotypering aanbevolen bij het optreden van bijwerkingen of bij het vaststellen van ineffectiviteit na het starten van een behandeling met een SSRI of SNRI.28
Genotypering wordt eveneens aangeraden in het geval van een afwijkende reactie op geneesmiddelen die door CYP2D6 en/of CYP2C19 worden omgezet. Een (extreem) snel of traag metabolisme van antidepressiva wordt namelijk in veel gevallen veroorzaakt door genetische variaties of polymorfismen in CYP2D6- en CYP2C19-enzymactiviteit. Zo komt een trage CYP2D6-metabolisatie voor bij respectievelijk 7% en 0,8%, en een trage CYP2C19-metabolisatie voor bij respectievelijk 2% en 19% van de blanke (Europese en Noord-Amerikaanse) en Aziatische bevolking. Het kan bijgevolg belangrijk zijn met deze etnisch bepaalde verschillen rekening te houden bij de inname van de SSRI’s paroxetine en fluvoxamine (hoofdzakelijk gemetaboliseerd door CYP2D6), en van (es)citalopram en sertraline (hoofdzakelijk gemetaboliseerd door CYP2C19).3,4,29,30
De potentiële klinische waarde van het combineren van TDM met genotypering werd benadrukt door een grootschalige Noorse studie (n = 2087), waarbij aangetoond werd dat het CYP2C19-genotype een substantiële impact heeft op het therapeutisch effect van escitalopram. Vooral patiënten met een depressieve stoornis en (extreem) snel of traag metabolisme voor escitalopram zouden een voordeel hebben bij een dergelijke aanpak, met name in landen waar een hogere prevalentie van het CYP2C19-genotype vastgesteld werd (zoals in landen uit Zuidoost-Azië).29
Conclusie
Deze studie toont aan dat er weinig evidentie lijkt te zijn voor het argument dat methodologische tekortkomingen van studies een verklaring zouden kunnen bieden voor de niet-consistente resultaten die gevonden worden voor het gebruik van TDM bij moderne antidepressiva. Dit neemt niet weg dat TDM tijdens de toediening van moderne antidepressiva nuttig kan zijn, zeker in combinatie met genotypering, voor bepaalde patiëntenpopulaties of in specifieke situaties.
Literatuur
1 Hart XM, Eichentopf L, Lense X, e.a. Therapeutic reference ranges for psychotropic drugs: a protocol for systematic reviews. Front Psychiatry 2021; 12: 787043.
2 Funk CSM, Hart XM, Gründer G, e.a. Is therapeutic drug monitoring relevant for antidepressant drug therapy? Implications from a systematic review and meta-analysis with focus on moderating factors. Front Psychiatry 2022; 13: 826138.
3 Hiemke C, Bergemann N, Clement HW, e.a. Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: update 2017. Pharmacopsychiatry 2018; 51: 9-62.
4 Schoretsanitis G, Paulzen M, Unterecker S, e.a. TDM in psychiatry and neurology: a comprehensive summary of the consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology, update 2017; a tool for clinicians. World J Biol Psychiatry 2018; 19: 162-74.
5 Fiaturi N, Greenblatt DJ. Therapeutic drug monitoring of antidepressants. Handb Exp Pharmacol 2019; 250: 115-33.
6 Baldelli S, Cheli S, Montrasio C, e.a. Therapeutic drug monitoring and pharmacogenetics of antipsychotics and antidepressants in real life settings: a 5-year single centre experience. World J Biol Psychiatry 2021; 22: 34-45.
7 Steegen G, Catthoor KCEER, Sabbe BGC, e.a. Tussen respons en resistentie: pseudoresistentie bij de behandeling van een depressieve stoornis. Tijdschr Psychiatr 2021; 63: 189-96.
8 Kloosterboer SM, Vierhout D, Stojanova J, e.a. Psychotropic drug concentrations and clinical outcomes in children and adolescents: a systematic review. Expert Opin Drug Saf 2020; 19: 873-90.
9 Preskorn SH. Therapeutic Drug Monitoring (TDM) in psychiatry (part I): why studies attempting to correlate drug concentration and antidepressant response don’t work. J Psychiatr Pract 2014; 20: 133-7.
10 Zernig G, Hiemke C. Pharmacokinetic and pharmacodynamic principles. In: Riederer P, Laux G, Nagatsu T, e.a., editors. NeuroPsychopharmacotherapy. Springer Nature Switzerland AG; 2020. p. 1-19.
11 Breitenstein B, Scheuer S, Bruckl TM, e.a. Association of ABCB1 gene variants, plasma antidepressant concentration, and treatment response: results from a randomized clinical study. J Psychiatr Res 2016; 73: 86-95.
12 Hodgson K, Tansey K, Dernovsek MZ, e.a. Genetic differences in cytochrome P450 enzymes and antidepressant treatment response. J Psychopharmacol 2014; 28: 133-41.
13 Martiny K, Lunde M, Bech P, e.a. A short-term double-blind randomized controlled pilot trial with active or placebo pindolol in patients treated with venlafaxine for major depression. Nord J Psychiatry 2012; 66: 147-54.
14 Lobello KW, Preskorn SH, Guico-Pabia CJ, e.a. Cytochrome P450 2D6 phenotype predicts antidepressant efficacy of venlafaxine: a secondary analysis of 4 studies in major depressive disorder. J Clin Psychiatry 2010; 71: 1482-7.
15 Leuchter AF, Cook IA, Marangell LB, e.a. Comparative effectiveness of biomarkers and clinical indicators for predicting outcomes of SSRI treatment in Major Depressive Disorder: results of the BRITE-MD study. Psychiatry Res 2009; 169: 124-31.
16 Reis M, Aberg-Wistedt A, Agren H, e.a. Serum disposition of sertraline, N-desmethylsertraline and paroxetine: a pharmacokinetic evaluation of repeated drug concentration measurements during 6 months of treatment for major depression. Hum Psychopharmacol 2004; 19: 283-91.
17 Perez V, Puiigdemont D, Gilaberte I, e.a. Augmentation of fluoxetine’s antidepressant action by pindolol: analysis of clinical, pharmacokinetic, and methodologic factors. J Clin Psychopharmacol 2001; 21: 36-45.
18 Kasper S, Dotsch M, Kick H, e.a. Plasma concentrations of fluvoxamine and maprotiline in major depression: implications on therapeutic efficacy and side effects. Eur Neuropsychopharmacol 1993; 3: 13-21.
19 Preskorn SH, Silkey B, Beber J, e.a. Antidepressant response and plasma concentrations of fluoxetine. Annals of clinical psychiatry 1991; 3: 147-51.
20 Danish University Antidepressant Group. Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomipramine in a controlled multicenter study. Danish University Antidepressant Group. J Affect Disord 1990; 18: 289-99.
21 Nathan RS, Perel JM, Pollock BG, e.a. The role of neuropharmacologic selectivity in antidepressant action: fluvoxamine versus desipramine. J Clin Psychiatry 1990; 51: 367-72.
22 Hebenstreit GF, Fellerer K, Zochling R, e.a. A pharmacokinetic dose titration study in adult and elderly depressed patients. Acta Psychiatr Scand Suppl 1989; 350: 81-4.
23 Kelly MW, Perry PJ, Holstad SG, e.a. Serum fluoxetine and norfluoxetine concentrations and antidepressant response. Ther Drug Monit 1989; 11: 165-70.
24 De Wilde J, Mertens C, Overo KF, e.a. Citalopram versus mianserin. A controlled, double-blind trial in depressed patients. Acta Psychiatr Scand 1985; 72: 89-96.
25 De Wilde JE, Mertens C, Wakelin JS. Clinical trials of fluvoxamine vs chlorimipramine with single and three times daily dosing. Br J Clin Pharmacol 1983; 15: 427S-31S.
26 Braun C, Adams A, Rink L, e.a. In search of a dose-response relationship in SSRIs-a systematic review, meta-analysis, and network meta-analysis. Acta Psychiatr Scand 2020; 142: 430-42.
27 Dold M, Kasper S. Dose-response relationship of selective serotonin reuptake inhibitors. Acta Psychiatr Scand 2020; 142: 427-9.
28 Piacentino D, Bianchi E, De Donatis D, e.a. Therapeutic drug monitoring of antidepressants: an underused but potentially valuable tool in primary care. Front Psychiatry 2022; 13: 867840.
29 Jukić MM, Haslemo T, Molden E, e.a. Impact of CYP2C19 genotype on escitalopram exposure and therapeutic failure: a retrospective study based on 2,087 patients. Am J Psychiatry 2018; 175: 463-70.
30 Mitchell PB. Therapeutic drug monitoring of antidepressant and antipsychotic drugs. In: Hempel G, red. Handbook of analytical separations. Elsevier Science; 2020. p. 257-75.
31 Nederlandse Vereniging voor Psychiatrie (NVvP). Leidraad farmacogenetica voor de dagelijkse psychiatrische praktijk. Utrecht: NVvP; 2020. https://www.nvvp.net/website/nieuws/2020/leidraad-farmacogenetica-voor-de-dagelijkse-psychiatrische-praktijk
32 Hicks JK, Bishop JR, Gammal RS, e.a. A call for clear and consistent communications regarding the role of pharmacogenetics in antidepressant pharmacotherapy. Clin Pharmacol Ther 2020; 107: 50-2.
33 Lo C, Nguyen S, Yang C, e.a. Pharmacogenomics in Asian subpopulations and impacts on commonly prescribed medications. Clin Transl Sci 2020; 13: 861-70.
Appendices
Tabel 1Authors
Kirsten Catthoor, psychiater psychosezorg, Psychiatrisch Ziekenhuis Stuivenberg, Ziekenhuis Netwerk Antwerpen (ZNA), Antwerpen, onderzoeker, Collaborative Antwerp Psychiatric Research Institute (CAPRI), en voorzitter Vlaamse Vereniging voor Psychiatrie.
Geertje Steegen, psychiater, psychosezorg, UVC Brugmann, Laken.
Marc De Hert, psychiater, Departement Neurowetenschappen, Onderzoeksgroep Psychiatrie, UPC Z.org KU Leuven, Kortenberg, Leuven Brain Institute KU Leuven, en AHLEC, Leerstoel Gezondheidsrecht en Gezondheidsethiek Universiteit Antwerpen.
Maarten Van Den Bossche, psychiater, afd. Ouderen- en Neuropsychiatrie, UPC KU Leuven; hoofddocent, Center for Neuropsychiatry, Onderzoeksgroep Psychiatrie, Departement Neurowetenschappen, Leuven Brain Institute, KU Leuven.
Bernard Sabbe, psychiater, emeritus gewoon hoogleraar, Faculteit Geneeskunde en Gezondheidswetenschappen, vakgroep CAPRI, Universiteit Antwerpen.
Tom Dreesen, psychiater, Mentona, Ambulant centrum voor psychiatrie en psychotherapie, Hoelbeek.
Johan Detraux, psycholoog, Departement Neurowetenschappen, Onderzoeksgroep Psychiatrie, UPC Z.org KU Leuven, Kortenberg.
Correspondentie
Johan Detraux (johan.detraux@upckuleuven.be).
Strijdige belangen
Dit onderzoeksproject werd mede mogelijk gemaakt dankzij een unrestricted financiële ondersteuning door Janssen Pharmaceutica, Lundbeck en Eli Lilly.
Het artikel werd voor publicatie geaccepteerd op 19-8-2024.
Citeren
Tijdschr Psychiatr. 2024;66(10):597-602
