De toekomst van predictiemodellen voor precisiepsychiatrie
Achtergrond Bij precisiepsychiatrie beoogt men geestelijke gezondheidszorg toe te spitsen op het individu, om zo onzekerheid over prognose en behandelrespons te verminderen.
Doel Uitdagingen identificeren die de implementatie van precisiepsychiatrie in de weg staan en voorstellen doen voor toekomstig onderzoek.
Methode Narratieve review over uitdagingen voor precisiepsychiatrie.
Resultaten Er is veel nadruk gelegd op technische innovatie voor datagedreven predictiemodellen van behandeluitkomsten. De complexe en dynamische aard van mentale gezondheid vormt een belangrijke uitdaging voor de succesvolle implementatie van deze modellen. Onderzoek in representatieve populaties, passende uitkomstdefinities, en het meewegen van context en gedrag zijn cruciaal. Ook validatie en implementatie vereisen meer aandacht.
Conclusie Er is een verschuiving nodig van retrospectief onderzoek dat gebaseerd is op lineaire en statische ziekteconcepten naar prospectief onderzoek, waarbij men de invloed van contextuele factoren en de dynamische en complexe aard van geestelijke gezondheid erkent.
Individuele behandeluitkomsten en prognoses zijn in de psychiatrie moeilijk te voorspellen. Precisiepsychiatrie is een onderzoeksveld dat zich richt op deze uitdaging.1,2 Er worden onder andere machinelearningalgoritmen getraind op omvangrijke datasets om diagnoses te stellen of behandeleffecten te voorspellen, en zo psychiatrische behandelingen te personaliseren.3
Wat is het probleem?
Het precisieonderzoek is nog in ontwikkeling, maar in recente reviews is men hoopvol over deze benadering.4,5 Decennia van dataverzameling hebben grote datasets opgeleverd met naast klinische gegevens ook informatie over genetica, neuro-imaging, omgevingsfactoren, (fysiologische) gegevens van wearables, en karakteristieken uit de verschillende ‘-omica’.6 Doorbraken in de artificiële intelligentie maken het mogelijk om deze data in samenhang te analyseren. Predictiemodellen voor de respons op behandeling met antipsychotica halen in recente studies bijvoorbeeld een hoge nauwkeurigheid.4,7 Dit roept de vraag op wanneer we in de klinische praktijk de vruchten kunnen plukken van deze vooruitgang, bijvoorbeeld in de vorm van gepersonaliseerde voorspelmodellen om behandelbeslissingen te ondersteunen.8 Er is echter beperkt onderzoek naar de vertaling van dit soort modellen naar klinische toepassingen.
In dit overzichtsartikel beschrijf ik aan de hand van tien uitdagingen voor precisiepsychiatrie waarom we de aandacht in dit veld moeten verleggen naar onderzoek waarbij we de complexe en dynamische aard van mentale gezondheid erkennen. De voorbeelden zijn met name gericht op schizofreniespectrumstoornissen omdat deze groep het beste onderzocht is, maar de beschreven uitdagingen gelden ook voor andere stoornissen.
Classificatie of voorspelling: waarvoor precies?
De voorspelling van toekomstige uitkomsten is de klinisch meest relevante toepassing van de precisiebenadering. Datagedreven classificatie van patiënten vergeleken met een ‘gouden standaard’ zoals de DSM-5 heeft, zoals bekend, weinig waarde: de specifieke mix van symptomen van een individu en de evolutie ervan over tijd passen vaak slecht in één classificatie.9-11 Daarnaast is er heterogeniteit in symptomen tussen patiënten met dezelfde classificatie, is de classificatie zelf een beperkte indicator voor behandelgevoeligheid, en zijn de zwakke pathofysiologische associaties geen basis voor de diagnose.12
Precisiestudies richten zich daarom op datagedreven subtypering van patiënten op basis van bestaande datasets, om vervolgens de prognose of de behandeluitkomst tussen categorale subtypen te vergelijken. Als alternatief kan in datasets van afgeronde gerandomiseerde gecontroleerde trials (RCT’s) worden gezocht naar predictoren van behandeluitkomsten. Met die informatie kan vervolgens een predictiemodel worden getraind om uitkomsten van ongeziene data te voorspellen. Maar ook deze aanpak heeft verschillende valkuilen die de vertaling naar de klinische praktijk beperken, zoals ik in het navolgende zal bespreken.
Patiëntselectie
Patiënten met een psychiatrische stoornis die deelnemen aan wetenschappelijk onderzoek naar behandelrespons en/of prognose moeten daarvoor informed consent geven, en om goede redenen. Maar patiënten met specifieke kenmerken op het moment van beoordeling, zoals paranoïde wanen, worden daardoor systematisch uitgesloten van onderzoek.13 Ook worden patiënten vaak uitgesloten als ze worden behandeld onder een juridische maatregel.14 Patiënten met een lichte tot matig-ernstige ontregeling zijn hierdoor oververtegenwoordigd in beschikbare data.13 Onderzoek op basis van deze data is daardoor beperkt generaliseerbaar naar andere populaties en instellingen. Wanneer klinische informatie wordt gebruikt als voorspeller in een predictiemodel van behandelingsuitkomst, heeft deze selectie een extra negatieve impact: de (verdeling van) eigenschappen wijkt af van de gegevens in de klinische praktijk, waardoor de generaliseerbaarheid van bevindingen verder afneemt.15
Voor de behandeling van een psychose zijn bijvoorbeeld mannelijk geslacht, onvervulde psychosociale behoeften en beperkingen in het functioneren voorspellers van slechtere klinische uitkomsten die ook de waarschijnlijkheid van dwangmaatregelen vergroten.16 Omdat dwangmaatregelen vaak een uitsluitingscriterium zijn van klinische onderzoeken, zal dit de prestaties van het voorspellingsmodel in de klinische praktijk negatief beïnvloeden.
Voor toekomstig onderzoek moet men daarom modellen trainen op basis van representatieve gegevens uit de klinische praktijk en exclusiecriteria beperken.
Fairness
Diversiteit en inclusie zijn essentieel voor implementatie van precisiegeneeskunde, al helemaal voor de psychiatrie, omdat maatschappelijke uitsluiting en discriminatie rechtstreeks verband houden met de ontwikkeling van psychiatrische aandoeningen. De vertegenwoordiging van minderheidsgroepen die gevoelig zijn voor uitsluiting is daarom bijzonder relevant. Zij worden echter ondervertegenwoordigd in onderzoeksdata, bijvoorbeeld door een taalbarrière die afname van gestandaardiseerde interviews belemmert.17 Geografische ondervertegenwoordiging in onderzoeksdata is een andere factor die de generaliseerbaarheid van predictiemodellen beperkt.18 Daarnaast moeten de algoritmen zelf fair zijn, dat wil zeggen niet bevooroordeeld zijn of gebaseerd zijn op discriminerende variabelen. Er kunnen tot slot onopgeloste of nog niet-geïdentificeerde kwesties zijn wat betreft inclusiviteit in onderzoek naar precisiepsychiatrie.19 Een aanbeveling is daarom om een verklaring over inclusiviteit en fairness op te nemen in publicaties over precisiepsychiatrie, met oog op transparantie, zoals ook is voorgesteld voor het gebruik van referenties.20
Behandeldosering en -duur
In veel medicatietrials bleken patiënten achteraf behandeld met een dosis of met een duur die onvoldoende is voor de evaluatie van de behandelingseffectiviteit.21 Veel klinisch onderzoek is ontworpen om de effectiviteit van een middel aan te tonen en niet om de optimale dosis en duur van de behandeling te bepalen. De optimale dosis en de minimale behandelduur om een effect te bereiken kunnen per persoon verschillen, en de optimale dosis voor behandeleffecten wordt regelmatig niet bereikt vanwege bijwerkingen.22 Onverdraagbaarheid van een behandeling is een heel belangrijk, maar ander probleem dan behandelingseffectiviteit. Patiënten kunnen hierdoor worden gelabeld als ‘non-responders’ op een behandeling, terwijl die behandeling in feite potentieel effectief zou kunnen zijn omdat de minimaal effectieve dosis nooit wordt bereikt vanwege intolerantie.
Ten slotte hebben veel onderzoeken een relatief korte follow-upduur. Dit kan leiden tot onderschattingen van de effectiviteit (en overschattingen van de tolerantie) van de behandeling omdat een langere follow-upduur nodig was. Dit kan ook leiden tot overschatting van de effectiviteit bij anderen, omdat de behandelingseffecten alleen werden geëvalueerd onder strikte voorwaarden (bijvoorbeeld tijdens ziekenhuisopname), die mogelijk niet de werkelijke werking van de patiënt in de echte wereld vertegenwoordigen (zie figuur 1).
Figuur 1. Verdeling van respons- en remissieclassificatie als een functie van behandeldosis en -duur
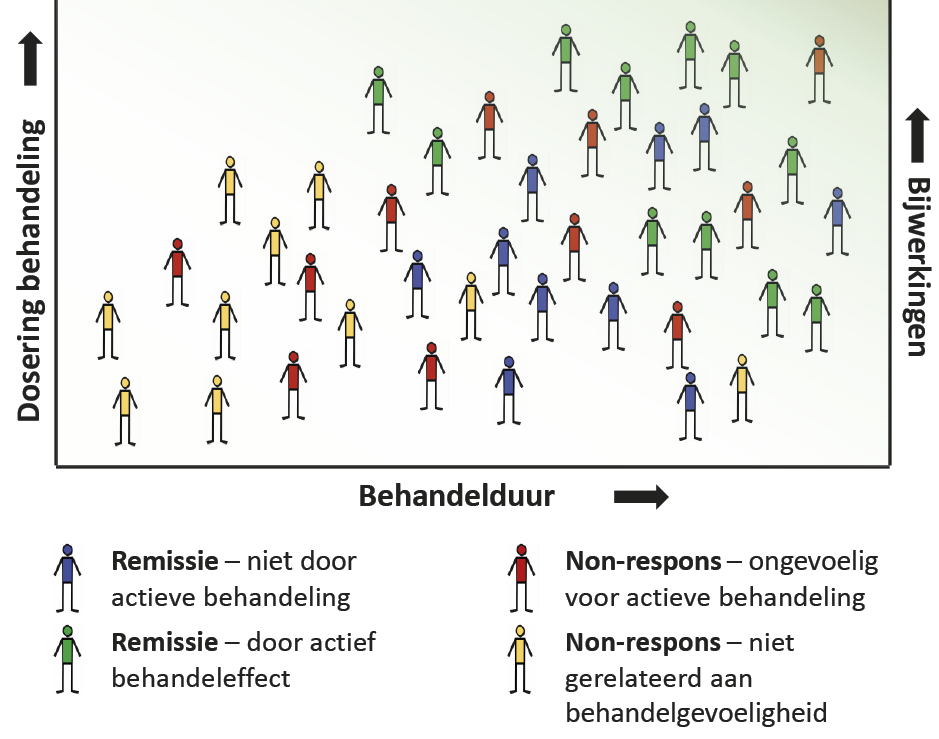
Patiënten die met medicatie (of andere interventies zoals psychotherapie) worden behandeld in studies naar behandelrespons worden vaak geclassificeerd als respons/remissie of non-respons. De dosering en de duur van de behandeling variëren echter in klinische proeven, en het gekozen regime kan leiden tot onnauwkeurige classificaties vanwege te lage dosering of te korte behandelduren. Daarnaast kunnen patiënten de behandeling staken vanwege bijwerkingen voordat een optimale dosis voor behandeleffect wordt bereikt. Deze factoren beperken de validiteit van klinische gegevens om te worden gebruikt als ‘gouden standaard’ voor voorspelling van behandelsrespons.
Deze problemen gelden voor medicatietrials, maar kunnen ook optreden in onderzoeken naar andere interventies, zoals psychotherapie of hersenstimulatie. Minimaal effectieve dosis en duur moeten daarom worden gedefinieerd in uitkomstvoorspellingsstudies, maar worden momenteel zelden gerapporteerd.
Behandelrespons
In de klinische praktijk zijn de effecten van een interventie op individueel niveau niet te onderscheiden van placebo-effecten en het natuurlijke beloop van de aandoening.23 Dit is in het bijzonder relevant in de psychiatrie, omdat placebo-effecten relatief sterker zijn dan actieve behandelingseffecten.12,24 Daarnaast zijn de effecten van psychofarmaca of psychotherapie ten minste gedeeltelijk gebaseerd op afzonderlijke (biologische) mechanismen.25 Dit zijn belangrijke beperkingen voor onderzoek naar voorspellers van behandelrespons in de psychiatrie, vooral als deze voorspellers gebaseerd zijn op biologische data. Toch worden deze beperkingen maar zelden overwogen.
Een gedachte-experiment van een onderzoek met een theoretische perfecte voorspeller van behandelrespons biomarker x toont de implicaties van deze bias. Deze biomarker x zal responders op een behandeling alleen als zodanig categoriseren als zij gevoelig zijn voor de actieve behandelingseffecten. Alle andere patiënten – ook zij die door andere factoren dan de ‘actieve stof’ van de interventie herstellen – worden gelabeld als non-responder. In de praktijk herstellen deze patiënten echter ook en zijn zij niet te onderscheiden van patiënten die daadwerkelijk baat hadden bij de interventie. In een onderzoek naar de nauwkeurigheid van biomarker x zullen deze patiënten daarom als fout-negatieven worden gelabeld (zie figuur 2).
Volgens een consensusverklaring van de American Psychiatric Association (APA) voor (neuro-imaging-)markers, moet een biomarker ten minste 80% sensitief, 80% specifiek en 80% nauwkeurig zijn om als betrouwbaar te worden beschouwd.26 Voor het ontwikkelen van een perfect betrouwbare voorspeller die aan deze eisen voldoet – zoals biomarker x of een voorspeller van welke aard dan ook – zou een behandeling ten minste 4 keer (80%/20%)zo effectief moeten zijn als placebo om de placeborespons in de ‘gouden standaard’-gegevens teniet te doen. Hierdoor zal elke theoretisch perfecte voorspeller de betrouwbaarheidstest in klinische onderzoeken niet doorstaan (zie figuur 2).
Figuur 2. Verwachte modelprestaties voor een ‘gouden standaard’-model getest op klinische gegevens van patiënten met stoornissen binnen het schizofreniespectrum
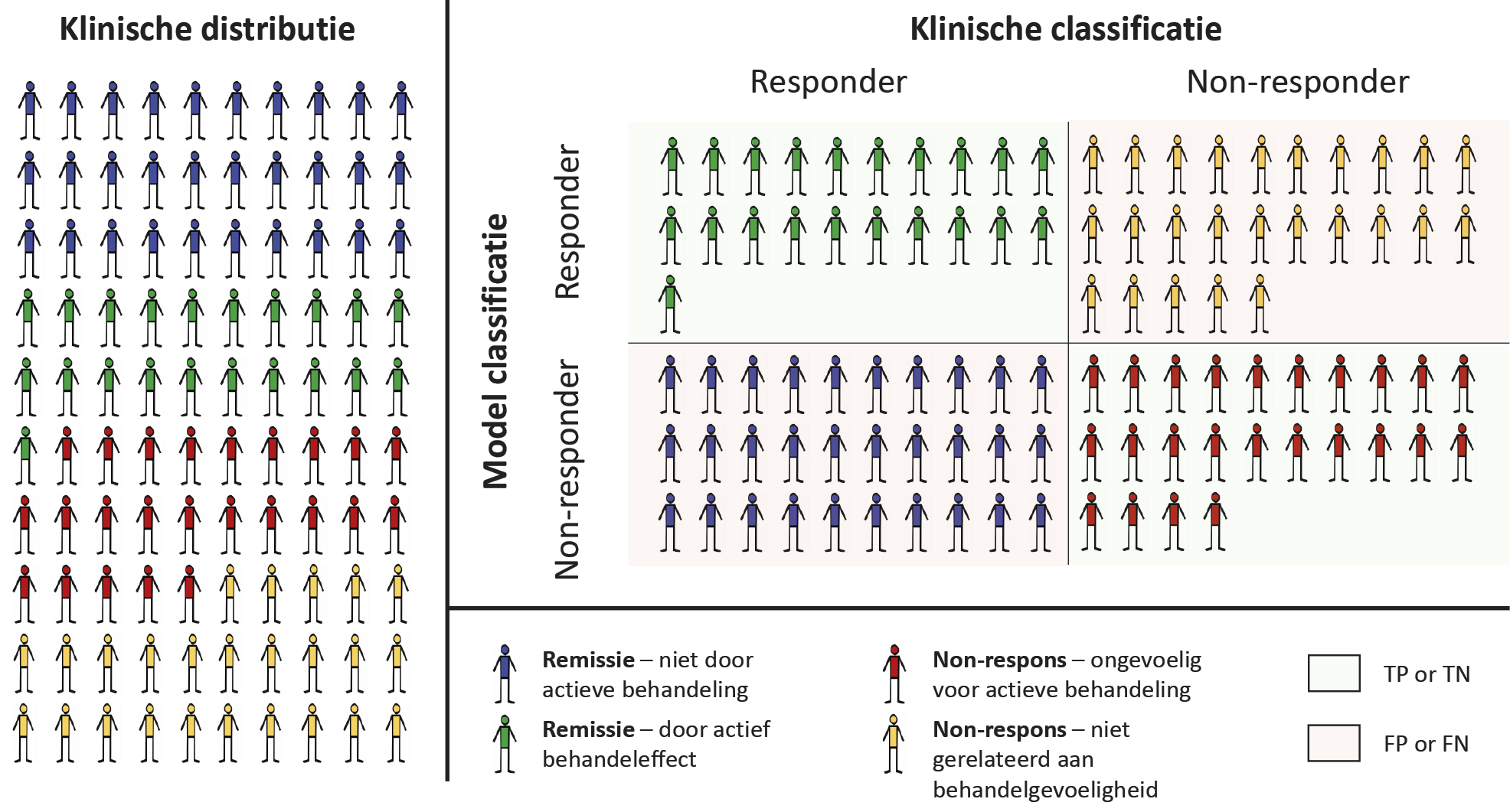
Klinische verdeling (linkerpaneel) van behandelrespons op antipsychotica.22,27,28 In een dataset, bijvoorbeeld verkregen in een RCT van een interventie zoals antipsychotische medicatie, worden patiënten geclassificeerd als responder of non-responder op basis van een klinische evaluatie bij follow-up. Informatie verkregen vóór behandeling kan worden gebruikt om dergelijke uitkomsten retrospectief te voorspellen en worden getest tegen deze klinische classificatie. Dit wordt gevisualiseerd voor een theoretische ‘perfecte voorspeller’ (rechterpaneel), die in de praktijk een lage nauwkeurigheid zal hebben. Patiënten kunnen remissie hebben bereikt door factoren die niet gerelateerd zijn aan de actieve behandeling (bijvoorbeeld placebo-effecten), en meta-analyses suggereren dat dit het geval is voor 30 van de 51 responders. Evenzo kan het niet-reageren het resultaat zijn van niet-behandelingsgerelateerde factoren, zoals therapieontrouw of sociale factoren (ongeveer 25 van de 49 niet-responders). Als gevolg hiervan zullen voorspellingsmodellen gebaseerd op dergelijke studiedesigns fout-positieve toewijzingen aan een responsgroep en fout-negatieve toewijzingen aan een non-responsgroep hebben. Modellen gebaseerd op deze aanpak zullen daarom waarschijnlijk niet de nauwkeurigheid bereiken die nodig is voor implementatie in de klinische praktijk. TP = terecht-positief; TN = terecht-negatief; FP = fout-positief; FN = fout-negatief.
Studies die een hoge nauwkeurigheid rapporteren voor het voorspellen van behandelrespons zonder dat erin gecorrigeerd wordt voor natuurlijk beloop van de stoornis en voor placebo-effecten, moeten daarom met de nodige scepsis worden geïnterpreteerd.
Behandelnon-respons
Men kan betogen dat de effecten van placebo en natuurlijke fluctuaties in mentale gezondheid kunnen worden omzeild door non-respons in plaats van respons te voorspellen. Helaas kunnen verschillende factoren fout-negatieve bevindingen veroorzaken in de groep van non-responders (d.w.z. de behandeling wordt gelabeld als ineffectief voor een persoon, hoewel deze effectief had kunnen zijn). Bij patiënten met een schizofreniespectrumstoornis wordt therapietrouw bijvoorbeeld op 50% geschat (waarbij 75% van de medicatiegiften volgens voorschrift wordt ingenomen).27 In een onderzoek naar de theoretisch perfecte voorspeller zullen deelnemers worden geclassificeerd als responders terwijl ze klinisch geen respons laten zien door therapieontrouw. Zij zullen daarom worden beschouwd als ‘fout-positieven’, waardoor opnieuw niet aan de betrouwbaarheidscriteria wordt voldaan.
Het uitsluiten van patiënten met therapieontrouw bij precisieonderzoek zal selectiebias induceren. Sociale omstandigheden en externe factoren zoals aanhoudende blootstelling aan cannabis of (traumatische) stressoren tijdens de behandeling kunnen verder bijdragen aan de ineffectiviteit van de behandeling.28,29 In klinische onderzoeken kunnen deze factoren als willekeurig worden beschouwd in vergelijkingen tussen actieve en placebo-interventies, maar deze aanname gaat voor precisiemodellen niet op.
Studiedesigns die mogelijk uitkomst bieden, zijn predictiestudies met een placeboarm (indien ethisch verdedigbaar en haalbaar), en openlabeltrials met geblindeerde stopzetting. Dit zou het mogelijk maken om de proportionele verbetering als gevolg van ‘echte’ behandelingseffecten te voorspellen.30 Soortgelijke benaderingen kunnen worden gebruikt om schattingen van het natuurlijke beloop van de aandoening of non-therapietrouw op te nemen, om de prestaties van het model in de klinische praktijk te verbeteren. Een andere veelbelovende aanpak bij patiënten in relatief stabiele mentale toestand en een focus op behandelingseffecten op korte termijn is de opname van informatie uit meta-analyses van meerdere n=1-studies, waarbij de impact van de behandeling wordt gerandomiseerd binnen een individu.31
Uitkomstdefinities
Psychiatrische stoornissen vormen een spectrum of continuüm, variërend van chronisch invaliderende ziekte tot kortstondige, voorbijgaande en niet-klinische ervaringen.32 Het spectrum komt tot uiting op meerdere niveaus, waaronder symptoomernst, genetische kwetsbaarheid, neuroanatomische correlaten en mate van herstel.32-35 Het vertalen van deze inzichten naar definities van een succesvolle behandeluitkomst in de kliniek is een onopgelost probleem. Op basis van vragenlijsten en gestructureerde interviews zijn voor verschillende stoornissen remissiecriteria afgesproken, maar sommige patiënten hebben toch behandeling nodig, terwijl zij bij voorbaat al aan deze criteria voldoen.
Als alternatief kan behandelingsrespons (willekeurig) worden gedefinieerd door een afkappunt te kiezen voor een ernstscore, maar symptoomafname door behandeling volgt een normaalverdeling, en de classificatie die volgt uit deze aanpak is daarom niet valide (zie figuur 3).36,37 Daarnaast zijn voor patiënten andere uitkomsten zoals sociaal of functioneel herstel regelmatig belangrijker dan symptoomreductie. Als dat zo is, moeten deze uitkomsten het uitgangspunt zijn voor predictiemodellen ter ondersteuning van gepersonaliseerde zorg.38 Bij gebruik van uitkomstpredictiemodellen in de praktijk moeten we dus kritisch kijken of de gemodelleerde uitkomsten aansluiten bij de persoonlijke behandeldoelen.
Figuur 3. Visualisatie van het instellen van een willekeurige drempelwaarde in symptoomreductie op de verdeling van responders en non-responders in klinische gegevens
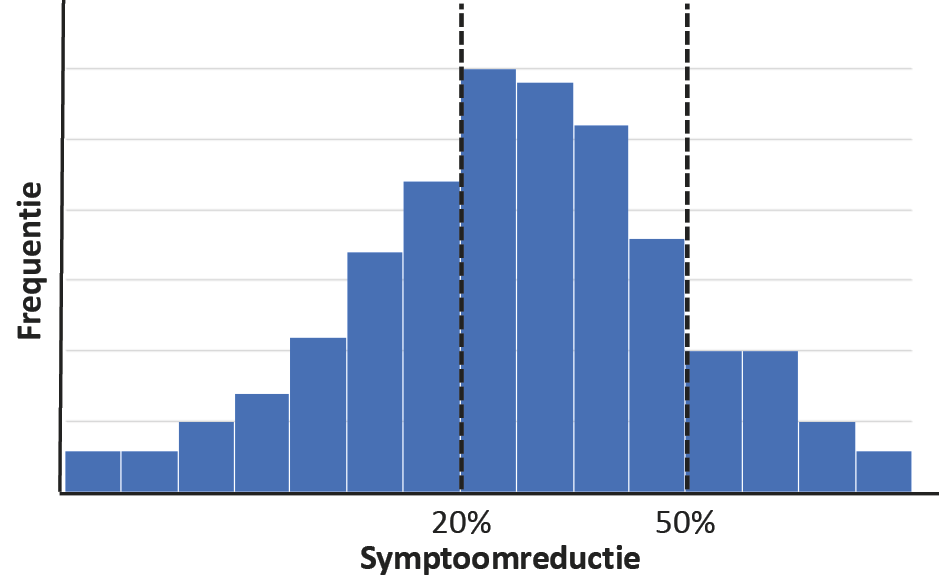
Bij studies naar behandeluitkomsten gebruikt men vaak een relatieve symptoomreductie na behandeling met een willekeurig vastgesteld afkappunt (bijv. 20% of 50% reductie vergeleken met de symptoomernstscore van het individu bij aanvang van het onderzoek) om behandelrespons te definiëren. De impliciete veronderstelling van deze benadering is dat patiënten kunnen worden gedichotomiseerd in responders en non-responders. Klinische gegevens van behandelstudies tonen echter vaak een normale verdeling in zowel absolute als relatieve symptoomreductie. Hierdoor beperkt de willekeurige drempelwaarde de (pathofysiologische) plausibiliteit van dergelijke voorspellingsmodellen.36 Het gebruik van continue uitkomsten heeft daarom de voorkeur.
Validatie en implementatie
Externe validatie van voorspellingsmodellen in onafhankelijke, naturalistische cohorten is vereist om de generaliseerbaarheid van bevindingen vast te stellen. Daarnaast moet men voorspellingsalgoritmen prospectief testen voordat ze klinisch kunnen worden geïmplementeerd. In de huidige literatuur ontbreken niet alleen deze toetsen, maar ook de vergelijking met bestaande zorgnormen.39 De evaluatie van deze modellen op basis van symptoomscores kan een mismatch tonen met patiëntuitkomsten wanneer factoren zoals verdraagbaarheid van de behandeling niet worden meegenomen (een behandeling kan bijvoorbeeld leiden tot de voorspelde symptoomreductie, maar door bijwerkingen toch leiden tot een verslechtering van het functioneren).40 Prospectieve validatie van voorspellingsmodellen in de klinische praktijk is dus cruciaal, maar wordt zelden uitgevoerd.
Precisiemodellen moeten niet alleen nauwkeurig blijken in de praktijk, maar ook praktisch implementeerbaar zijn. Of dit het geval is, wordt zelden meegewogen in het huidige onderzoek.39 Factoren die implementatie kunnen belemmeren, zijn onder meer beperkte toegang tot gegevens en middelen en onbekendheid met voorspellingsmodellen onder zorgverleners en patiënten.41 Dit risico neemt toe naarmate de complexiteit van de modellen groter wordt en aannames en werking van het model minder transparant worden.
Ten slotte kan de implementatie van predictiemodellen leiden tot veranderingen in de zorgvraag. Dit kan op zijn beurt de validiteit van het model beïnvloeden. Bepaalde behandelopties kunnen aantrekkelijker worden als de uitkomst beter voorspelbaar is (bijvoorbeeld als het optreden van ernstige bijwerkingen onwaarschijnlijk kan worden gemaakt). Algoritmen moeten zich daarom aanpassen aan een veranderende werkelijkheid, maar dit introduceert nieuwe uitdagingen, bijvoorbeeld wat betreft privacy.42 Federated learning – een leerparadigma om algoritmen collectief te trainen in lokale instellingen zonder gegevensuitwisseling – is een aantrekkelijke aanpak om dergelijke problemen op te lossen. Bij deze aanpak stuurt men modellen naar individuele zorginstellingen zonder persoonlijke gegevens uit te wisselen, zodat privacy wordt gewaarborgd. Elektronische patiëntendossiers moeten worden aangepast om dit soort oplossingen te faciliteren.43
Contextuele gedragsfactoren
Het integreren van context en dynamica van geestelijke gezondheid en gedrag in het (vaak biologisch georiënteerde) precisiekader is een grote uitdaging.44 Contextuele gedragswetenschap heeft aangetoond dat geestelijke gezondheid ontstaat uit de dynamische interactie tussen het individu en de omgeving.45 Het belang van de context voor psychiatrische behandeling blijkt bijvoorbeeld uit de toename van de placeborespons in wetenschappelijk onderzoek over de tijd.46 Factoren die behandeleffect kunnen beïnvloeden, zijn de therapeutische relatie, ondersteuning van de behandeling door het systeem van naasten, het lokale functioneren de ggz, en juridisch kader.16,47,48 Culturele factoren, overtuigingen, verwachtingen en waarden kunnen behandeluitkomsten ook – zowel positief als negatief – beïnvloeden.49
Bij precisiepsychiatrie gaat men er vaak (impliciet) vanuit dat de relatie tussen markers en behandelrespons stabiel is over de tijd en ongeacht de context. Dat is niet het geval, want alle genoemde factoren kunnen in de loop van de tijd veranderen. Een mogelijke oplossing is het gebruik van een integratieve aanpak tijdens de modelontwikkeling, waarbij statische en dynamische factoren die bijdragen aan uitkomsten worden gecombineerd. Daarnaast bieden deze inzichten ook kansen om behandeluitkomsten te optimaliseren voor het individu. Zo kan men bij behandeling met psychedelica de setting personaliseren voor de gewenste therapeutische ervaring. En contextuele factoren die dynamisch veranderen in de loop van de tijd kan men proberen te verbeteren met gerichte interventies. Voorbeelden zijn erkenning van de impact van (zelf)stigma en discriminatie, en afstemming van de therapie op de familiale, sociale en culturele context.
Van lineaire voorspellingen naar complexe dynamica
Op basis van de genoemde argumenten zullen lineaire predictiemodellen in de precisiepsychiatrie de zorg waarschijnlijk niet verbeteren, zelfs niet met complexe machinelearningbenaderingen.50 Ook bij deze modellen gaat men onterecht uit van een lineair voorspelbaar resultaat gebaseerd op factoren bij aanvang van een onderzoek. Vanuit volksgezondheidsperspectief heeft succesvolle implementatie van precisiepsychiatrie mogelijk slechts een beperkte impact.51 Dus hoe verder?
Geestelijke gezondheid kan beter worden begrepen als een complex dynamisch systeem.52 Complexiteitstheorie benadrukt dat systemen uniek zijn en individueel moeten worden benaderd. Patiënten vertonen een grote diversiteit in klinische symptomen en bijdragende factoren, die allemaal onderling verbonden zijn.12,36 Vooruitgang in symptoomnetwerkanalyse is veelbelovend, vooral als biologische, psychologische en sociale factoren hierin worden geïntegreerd.53 De geschiedenis van individuele elementen is cruciaal in complexe systemen, wat het belang van preventie in de geestelijke gezondheidszorg onderstreept.
Computationele psychiatrie en virtuele trials, gebaseerd op persoonlijke gegevens, zijn veelbelovende ontwikkelingen.54,55 Zo worden er momenteel virtuele hersenmodellen ontwikkeld om de impact van chirurgische interventies op epilepsie en hersentumoren te simuleren. Soortgelijke benaderingen kunnen we gebruiken om de impact van interventies in de psychiatrie te modelleren. Zo wordt momenteel onderzocht of een computationeel model van hersenactiviteit van individuele patiënten met een delier bruikbaar is om hun behandeling met transcraniële hersenstimulatie te personaliseren. Met het model van de patiënt wordt een behandeling eerst virtueel uitgevoerd en geoptimaliseerd, voordat men deze in de praktijk uitvoert.
Uiteindelijk moeten we specifieke en generieke interventies combineren om veerkracht en flexibiliteit te vergroten. Beide zijn essentieel voor de adaptiviteit van dynamische complexe systemen zoals mentale gezondheid.56,57 Een voorbeeld van deze geïntegreerde benadering is het zorgprogramma GeRichte Interventies bij Psychose (GRIP), gericht op omgaan met stemmen horen en herstel van psychose. In een dagbehandeling krijgen patiënten acceptance and commitment therapy (ACT) aangeboden in groepen voor psycho-educatie, gesprekstherapie en psychomotore therapie met nauwe betrokkenheid van ervaringsdeskundigen, om hun cognitieve flexibiliteit en weerbaarheid te vergroten. Daarnaast werken zij in individuele sessies aan persoonlijke doelen voor herstel, waarbij bijvoorbeeld antipsychotica, systeeminterventies, en aanpassingen in huisvesting en dagbesteding worden ingezet op basis van de hulpvraag, persoonlijke voorgeschiedenis en symptoomprofielen van de patiënt. Hierbij kan precisiepsychiatrie de keuze voor de meest passende medicatie ondersteunen, maar het effect van afzonderlijke interventies zoals medicatie kan niet los worden gezien van de bredere behandelcontext.
Conclusie
In het onderzoek naar precisiepsychiatrie moeten we beter onderkennen wat de beperkingen zijn van beschikbare datasets, zoals selectiebias en de ruisbevattende data over behandeleffecten in klinische onderzoeken. Voor methodologische innovaties moeten we implementatie in echte-wereldomstandigheden al vroeg in het proces overwegen, en fairness is daarbij een belangrijk uitgangspunt. Geestelijke gezondheid is een complex dynamisch systeem waarin contextuele gedragsfactoren een belangrijke rol spelen. Alleen door dit te onderkennen kunnen we technologische innovaties en big data benutten voor gepersonaliseerde psychiatrische zorg.
Noot
Dit artikel is een bewerkte vertaling van: van Dellen E. Precision psychiatry: predicting predictability, Psych Med 2024; 54: 1500-9.
Literatuur
1 Vieta E. Personalized medicine applied to mental health: Precision psychiatry. Rev Psiquiatr Salud Ment (English Ed.) 2015; 8: 117-8.
2 Fernandes BS, Williams LM, Steiner J, e.a. The new field of ‘precision psychiatry’. BMC Med 2017; 15: 1-7.
3 Bzdok D, Varoquaux G, Steyerberg EW. Prediction, not association, paves the road to precision medicine. JAMA Psychiatry 2021; 78: 127-8.
4 Coutts F, Koutsouleris N, McGuire P. Psychotic disorders as a framework for precision psychiatry. Nat Rev Neurol 2023 19:4 2023; 19: 221-4.
5 Scangos KW, State MW, Miller AH, e.a. New and emerging approaches to treat psychiatric disorders. Nat Med 2023 29: 317-33.
6 Topol EJ. Individualized medicine from prewomb to tomb. Cell 2014; 157: 241-53.
7 Dominicus LS, Oranje B, Otte WM, e.a. Macroscale EEG characteristics in antipsychotic-naïve patients with first-episode psychosis and healthy controls. Schizophrenia 2023 9:1 2023; 9: 1-10.
8 Chekroud AM, Bondar J, Delgadillo J, e.a. The promise of machine learning in predicting treatment outcomes in psychiatry. World Psychiatry 2021; 20: 154-70.
9 Plana-Ripoll O, Pedersen CB, Holtz Y, e.a. Exploring comorbidity within mental disorders among a Danish national population. JAMA Psychiatry 2019; 76: 259-70.
10 Romero C, Werme J, Jansen PR, e.a. Exploring the genetic overlap between twelve psychiatric disorders. Nat Genet 2022 54:12 2022; 54: 1795-802.
11 van Os J, Gilvarry C, Bale R, e.a. Diagnostic value of the DSM and ICD categories of psychosis: An evidence-based approach. Soc Psychiatry Psychiatr Epidemiol 2000; 35: 305-11.
12 van Os J, Guloksuz S, Vijn TW, e.a. The evidence-based group-level symptom-reduction model as the organizing principle for mental health care: time for change? World Psychiatry 2019; 18: 88-96.
13 Taipale H, Schneider-Thoma J, Pinzón-Espinosa J, e.a. Representation and outcomes of individuals with schizophrenia seen in everyday practice who are ineligible for randomized clinical trials. JAMA Psychiatry 2022; 79: 210-8.
14 Luciano M, Sampogna G, Del Vecchio V, e.a. Use of coercive measures in mental health practice and its impact on outcome: a critical review. Expert Rev Neurother 2014; 14: 131-41.
15 Brand BA, de Boer JN, Dazzan P, Sommer IE. Towards better care for women with schizophrenia-spectrum disorders. Lancet Psychiatry 2022; 9: 330-6.
16 Koutsouleris N, Kahn RS, Chekroud AM, e.a. Multisite prediction of 4-week and 52-week treatment outcomes in patients with first-episode psychosis: a machine learning approach. Lancet Psychiatry 2016; 3: 935-46.
17 Mamun A, Nsiah NY, Srinivasan M, e.a. Diversity in the era of precision medicine – from bench to bedside implementation. Ethn Dis 2019; 29: 517.
18 Meehan AJ, Lewis SJ, Fazel S, e.a. Clinical prediction models in psychiatry: a systematic review of two decades of progress and challenges. Molecular Psychiatry 2022 27:6 2022; 27: 2700-8.
19 Mitchell S, Potash E, Barocas S, e.a. Algorithmic fairness: choices, assumptions, and definitions. Annu Rev Stat Appl 2021; 8: 141-63.
20 Zurn P, Bassett DS, Rust NC. The citation diversity statement: a practice of transparency, a way of life. Trends Cogn Sci 2020; 24: 669-72.
21 Howes OD, McCutcheon R, Agid O, e.a. Treatment-resistant schizophrenia: Treatment Response and Resistance in Psychosis (TRRIP) working group consensus guidelines on diagnosis and terminology. Am J Psychiatry 2017; 174: 216-29.
22 Leucht S, Cipriani A, Spineli L, e.a. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: A multiple-treatments meta-analysis. Lancet 2013; 382: 951-62.
23 Howick J, Friedemann C, Tsakok M, e.a. Are treatments more effective than placebos? a systematic review and meta-analysis. PLoS One 2013; 8: e62599.
24 Leucht S, Leucht C, Huhn M, e.a. Sixty years of placebo-controlled antipsychotic drug trials in acute schizophrenia: Systematic review, Bayesian meta-analysis, and meta-regression of efficacy predictors. Am J Psychiatry 2017; 174: 927-42.
25 Chopra S, Francey SM, O’Donoghue B, e.a. Functional connectivity in antipsychotic-treated and antipsychotic-naive patients with first-episode psychosis and low risk of self-harm or aggression: a secondary analysis of a randomized clinical trial. JAMA Psychiatry 2021; 78: 994-1004.
26 First MB, Botteron KN, Castellanos FX, e.a. Consensus report of the APA Work Group on neuroimaging markers of psychiatric disorders 2012. https://www.psychiatry.org/psychiatrists/search-directories-databases/resource-documents/2012/neuroimaging-markers-of-psychiatric-disorders,-con
27 Lacro JP, Dunn LB, Dolder CR, e.a. Prevalence of and risk factors for medication nonadherence in patients with schizophrenia: A comprehensive review of recent literature. J Clin Psychiatry 2002; 63: 892-909.
28 Marsman A, Pries LK, ten Have M, e.a. Do current measures of polygenic risk for mental disorders contribute to population variance in mental health? Schizophr Bull 2020; 46: 1353-62.
29 Patel R, Wilson R, Jackson R, e.a. Association of cannabis use with hospital admission and antipsychotic treatment failure in first episode psychosis: an observational study. BMJ Open 2016; 6: e009888.
30 Hafliðadóttir SH, Juhl CB, Nielsen SM, e.a. Placebo response and effect in randomized clinical trials: meta-research with focus on contextual effects. Trials 2021; 22: 1-15.
31 Hendrickson RC, Thomas RG, Schork NJ, e.a. Optimizing aggregated N-of-1 trial designs for predictive biomarker validation: statistical methods and theoretical findings. Front Digit Health 2020; 2: 13.
32 Guloksuz S, van Os J. The slow death of the concept of schizophrenia and the painful birth of the psychosis spectrum. Psychol Med 2018; 48: 229-44.
33 Ripke S, Neale BM, Corvin A, e.a. Biological insights from 108 schizophrenia-associated genetic loci. Nature 2014 511:7510 2014; 511: 421-7.
34 van Dellen E, Bohlken MM, Draaisma L, e.a. Structural brain network disturbances in the psychosis spectrum. Schizophr Bull 2016; 42: 782-9.
35 van Os J, Linscott RJ, Myin-Germeys I, e.a. A systematic review and meta-analysis of the psychosis continuum: evidence for a psychosis proneness-persistence-impairment model of psychotic disorder. Psychol Med 2009; 39: 179-95.
36 Fried EI, Flake JK, Robinaugh DJ. Revisiting the theoretical and methodological foundations of depression measurement. Nat Rev Psychol 2022; 1: 358-68.
37 MacCallum RC, Zhang S, Preacher KJ, e.a. On the practice of dichotomization of quantitative variables. Psychol Methods 2002; 7: 19-40.
38 Maj M, van Os J, De Hert M, e.a. The clinical characterization of the patient with primary psychosis aimed at personalization of management. World Psychiatry 2021; 20: 4-33.
39 Salazar De Pablo G, Studerus E, Vaquerizo-Serrano J, e.a. Implementing precision psychiatry: a systematic review of individualized prediction models for clinical practice. Schizophr Bull 2021; 47: 284-97.
40 Chen JH, Asch SM. Machine learning and prediction in medicine – beyond the peak of inflated expectations. N Engl J Med 2017; 376: 2507.
41 Baldwin H, Loebel-Davidsohn L, Oliver D, e.a. Real-world implementation of precision psychiatry: a systematic review of barriers and facilitators. Brain Sci 2022; 12: 934.
42 Garralda E, Dienstmann R, Piris-Giménez A, e.a. New clinical trial designs in the era of precision medicine. Mol Oncol 2019; 13: 549-57.
43 McMahan B, Moore E, Ramage D, e.a. Communication-efficient learning of deep networks from decentralized data. Proceedings of the 20th International Conference on Artificial Intelligence and Statistics (AISTATS) 2017, Fort Lauderdale: PMLR; 2017: 1273-82. https://proceedings.mlr.press/v54/
44 Köhne ACJ, van Os J. Precision psychiatry: promise for the future or rehash of a fossilised foundation? Psychol Med 2021; 51: 1409-11.
45 Ford DH, Urban HB. Contemporary models of psychotherapy: a comparative analysis. Hoboken: Wiley; 1998. p. 768.
46 Weimer K, Colloca L, Enck P. Placebo effects in psychiatry: mediators and moderators. Lancet Psychiatry 2015; 2: 246-57.
47 Glick ID, Stekoll AH, Hays S. The role of the family and improvement in treatment maintenance, adherence, and outcome for schizophrenia. J Clin Psychopharmacol 2011; 31: 82-5.
48 Polese D, Fornaro M, Palermo M, e.a. Treatment-resistant to antipsychotics: A resistance to everything? Psychotherapy in treatment-resistant schizophrenia and nonaffective psychosis: A 25-year systematic review and exploratory meta-analysis. Front Psychiatry 2019; 10: 210.
49 de Andino AM, de Mamani AW. The moderating role of cultural factors and subclinical psychosis on the relationship between internalized stigma, discrimination, and mental help-seeking attitudes. Stigma Health 2022; 7: 214-25.
50 van Os J, Kohne ACJ. It is not enough to sing its praises: the very foundations of precision psychiatry may be scientifically unsound and require examination. Psychol Med 2021; 51: 1415-7.
51 Joyner MJ, Paneth N. Seven questions for personalized medicine. JAMA 2015; 314: 999-1000.
52 Borsboom D, Haslbeck JMB, Robinaugh DJ. Systems-based approaches to mental disorders are the only game in town. World Psychiatry 2022; 21: 420-2.
53 Borsboom D. A network theory of mental disorders. World Psychiatry 2017; 16: 5-13.
54 Jirsa V, Wang H, Triebkorn P, e.a. Personalised virtual brain models in epilepsy. Lancet Neurol 2023; 22: 443-54.
55 van Dellen E, Hillebrand A, Douw L, e.a. Local polymorphic delta activity in cortical lesions causes global decreases in functional connectivity. Neuroimage 2013; 83: 524-32.
56 Gao J, Barzel B, Barabási AL. Universal resilience patterns in complex networks. Nature 2016 530:7590 2016; 530: 307-12.
57 Davydov DM, Stewart R, Ritchie K, Chaudieu I. Resilience and mental health. Clin Psychol Rev 2010; 30: 479-95.
Auteurs
Edwin van Dellen, universitair hoofddocent psychiatrie en psychiater, afd. Psychiatrie, UMC Utrecht, afd. Neurologie, UZ Brussel en Vrije Universiteit Brussel.
Correspondentie
Dr. Edwin van Dellen (e.vandellen@umcutrecht.nl).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 8-10-2024.
Citeren
Tijdschr Psychiatr. 2025;67(2):94-99
