Consensusverklaring diepe hersenstimulatie bij obsessieve-compulsieve stoornis
Achtergrond Sinds 2013 wordt diepe hersenstimulatie (deep brain stimulation, DBS) in Nederland vergoed als bewezen effectieve behandeling voor therapieresistente obsessieve-compulsieve stoornis (OCS). Toch wordt DBS nog zelden toegepast en ontbreekt een landelijk behandelprotocol.
Doel Aanzet tot een landelijk multidisciplinair behandelprotocol voor de toepassing van DBS bij de behandeling van therapieresistente OCS.
Methode Formuleren van aanbevelingen voor de uitvoering en toepassing van DBS bij OCS wat betreft indicatiestelling, implantatie, optimalisatie van stimulatieparameters en consolidatie van effecten op de langere termijn, gebaseerd op literatuuronderzoek en consensus onder experts vertegenwoordigd in de Nederlandse Multidisciplinaire Werkgroep DBS in de Psychiatrie.
Resultaten Na indicatiestelling worden DBS-elektrodes bilateraal geïmplanteerd in wittestofbanen in het voorste been van de capsula interna. Bij patiënten met tot dan toe zeer therapieresistente, ernstige OCS leidt dit – na optimalisatie van de stimulatieparameters – tot gemiddeld 66% respons. Placebogecontroleerde effecten zijn groot (Hedges g = 0,9). De belangrijkste gerapporteerde bijwerkingen zijn voorbijgaande hypomane symptomen, vermoeidheid en subjectieve cognitieve klachten. Perioperatieve complicaties zijn zeldzaam. Positieve effecten blijven stabiel gedurende jarenlange follow-up. DBS is kostenbesparend en leidt tot toename van kwaliteit van leven en herstel van functioneren. Toch wordt DBS weinig toegepast in verhouding tot het geschatte aantal patiënten met therapieresistente OCS.
Conclusie Bij het volgen van de beschreven aanbevelingen rondom indicatiestelling, implantatie, optimalisatie en consolidatie is DBS een effectieve en veilige behandeloptie voor therapieresistente OCS. Een landelijk multidisciplinair behandelprotocol kan bijdragen aan implementatie van DBS met meer en eerdere verwijzingen, opdat meer patiënten sneller kunnen profiteren van deze behandeling.
Obsessieve-compulsieve stoornis (OCS) wordt gekenmerkt door dwanggedachten (obsessies) en/of dwanghandelingen (compulsies), met een geschatte lifetimeprevalentie van 1%.1,2 Behandeling met psychotherapie en/of farmacotherapie is effectief, maar bij ongeveer 10-25% van de patiënten blijft de OCS therapieresistent.2,3 Dit betekent dat naar schatting duizenden patiënten in Nederland therapieresistente OCS hebben met een aanzienlijke ziektelast voor henzelf, hun naasten en de samenleving.
Diepe hersenstimulatie (deep brain stimulation, DBS) wordt in Nederland sinds 2005 toegepast en sinds 2013 vergoed als bewezen effectieve behandeling voor ernstige en therapieresistente OCS. Behandeling met DBS bestaat uit vier opeenvolgende stappen: indicatiestelling, implantatie, optimalisatie van stimulatieparameters en consolidatie van effecten op de langere termijn.3-5 De indicatie wordt gesteld door een multidisciplinair team, waarbij men een inschatting maakt van de veiligheid, verwachte effectiviteit en haalbaarheid. Tijdens de implantatie plaatst de neurochirurg twee elektrodes in specifieke hersengebieden die via onderhuidse kabels verbonden zijn met een pulsgenerator. Continue toediening van elektrische pulsjes normaliseert de activiteit in disfunctionele hersencircuits. Tijdens de optimalisatie worden de keuze voor één of meerdere contactpunten per elektrode en de stimuluskarakteristieken zoals de amplitude, frequentie en pulsduur aangepast om het beste effect te bereiken met de minste bijwerkingen. In de consolidatiefase wordt zo nodig individueel aangepaste psychotherapie aangeboden, cognitieve gedragstherapie (CGT) of op maat gemaakte ondersteuning in combinatie met DBS.
Sinds de eerste publicatie over DBS bij OCS in 1999 zijn de effectiviteit en veiligheid herhaaldelijk aangetoond in gecontroleerde studies die zijn gecombineerd in meta-analyses (n = 352).6-8 Behalve tot symptoomreductie leidt DBS bij OCS tot hogere kwaliteit van leven en functioneel herstel met bijvoorbeeld zelfs werkhervatting.5,9 DBS voor OCS is kosteneffectief en zelfs kostenbesparend.10 Geobserveerde positieve effecten in een populatie met zeer therapieresistente OCS waren voldoende aanleiding om DBS voor OCS in 2013 te vergoeden vanuit de basiszorgverzekering.
Er zijn momenteel maar enkele centra in Nederland waar DBS bij OCS wordt toegepast (Amsterdam UMC, Maastricht UMC+, en UMC Groningen). Tot op heden hebben de centra elk een eigen protocol voor DBS bij OCS en ontbreekt een uniform landelijk protocol. Ook wordt DBS in de multidisciplinaire richtlijn Angststoornissen (uit 2013) nog steeds een experimentele behandelinterventie genoemd. Dit draagt wellicht bij aan de spaarzame implementatie van DBS bij OCS. Met een lifetimeprevalentie van 1% en een therapieresistentie van naar schatting 10-25% zijn er in Nederland duizenden patiënten met therapieresistente OCS, van wie er sinds 2005 slechts ongeveer 150 met DBS zijn behandeld.
In dit artikel doen wij als Multidisciplinaire Werkgroep DBS in de Psychiatrie aanbevelingen als aanzet voor een consensusprotocol voor de toepassing van DBS bij OCS. Aanbevelingen zijn gebaseerd op de huidige literatuur en – waar deze tekortschiet – consensus onder experts. Door de indicatie, implantatie, optimalisatie en consolidatie te beschrijven hopen we de kwaliteit en implementatie van DBS-behandeling bij ernstige therapieresistente OCS verder te verbeteren.
Methode
In navolging van consensusverklaringen en protocolvoorstellen in dit tijdschrift,11,12 maakten we gebruik van recente overzichtsartikelen, inclusief systematische reviews, meta-analyses en richtlijndocumenten. Publicaties werden geïdentificeerd door zoektermen gericht op OCS en DBS te combineren in PubMed en Google Scholar en te kijken naar kruisreferenties tot en met juni 2023. Op basis van consensus binnen de landelijke Multidisciplinaire Werkgroep DBS in de Psychiatrie werd alle beschikbare evidentie gewogen door alle auteurs en samengevat, inclusief twee consensusbijeenkomsten en herhaaldelijke schriftelijke commentaarrondes. Bij ontbreken van internationale protocollen vormden reeds beschikbare multidisciplinaire ziekenhuisprotocollen voor DBS bij OCS van het Amsterdam UMC en Maastricht UMC+ het uitgangspunt.
Resultaten
Indicatie
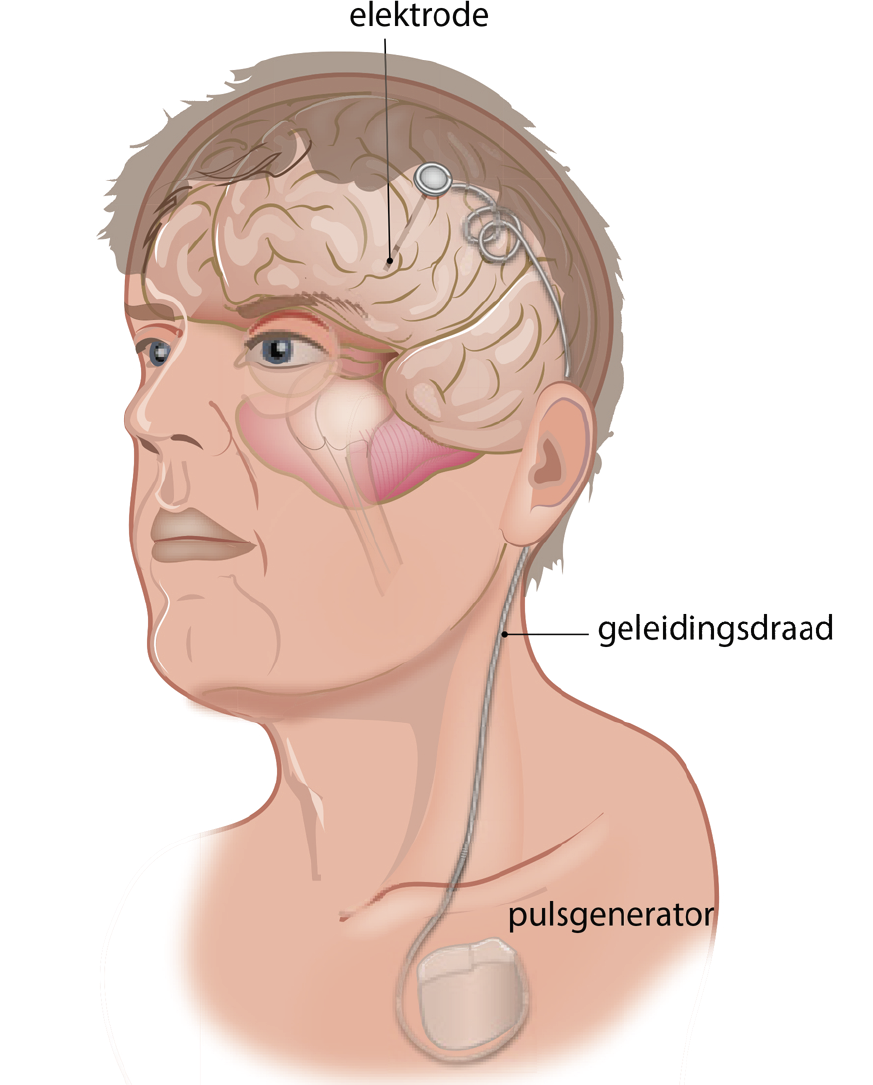
Bij DBS worden onder algehele narcose elektrodes in de hersenen geplaatst (figuur 1). Daar gaat een kritische indicatiestelling van patiënten aan vooraf. Het voornaamste doel is om volgens de principes van gedeelde besluitvorming patiënten te behandelen van wie wordt verwacht dat: 1. ze dermate zullen profiteren van DBS dat de voordelen in behandeleffect opwegen tegen mogelijke nadelen in de vorm bijwerkingen en risico’s en 2. DBS bij hen haalbaar is. Daartoe worden in een zorgvuldige multidisciplinaire procedure de indicatie primaire therapieresistente, ernstige OCS en absolute en relatieve contra-indicaties vastgesteld.
Figuur 1. Schematische weergave van de plaatsing van het DBS-systeem
Primaire OCS
DBS wordt ingezet voor OCS op basis van DSM-5-criteria gediagnosticeerd door een psychiater met langdurige ervaring met patiënten met OCS. Symptomen van andere stoornissen kunnen lijken op OCS, zoals rigiditeit en repetitief gedrag bij autismespectrumstoornis (ASS), starheid en ordelijkheid bij dwangmatige-persoonlijkheidsstoornis, rumineren bij depressie, dwanggedrag bij neurodegeneratieve aandoeningen, tics bij een ticstoornis, obsessies en compulsies bij andere obsessieve-compulsieve spectrumstoornissen zoals morfodysfore stoornis (body dysmorphic disorder, BDD) en intrusies bij posttraumatische stressstoornis. DBS wordt alleen ingezet als de lijdensdruk wordt verklaard door de dwangklachten bij OCS. Functionele dwangklachten die symptomen van een comorbide psychiatrische stoornis compenseren zoals bij schizofrenie, lichte verstandelijke beperking of een autismespectrumstoornis zijn geen indicatie. Onderscheidend is in dit geval het functionele en egosyntone karakter van de dwangklachten, terwijl OCS egodystoon is. Comorbiditeit is niet noodzakelijkerwijs een exclusiecriterium (zie onder het subkopje ‘Contra-indicaties’).
Therapieresistentie
Patiënten met OCS worden als therapieresistent beoordeeld als zij alle protocollaire medicatiestappen hebben doorlopen en een adequate cognitieve gedragstherapie (CGT) met exposure en responsepreventie hebben gevolgd bij een in OCS gespecialiseerde cognitieve gedragstherapeut. Medicamenteus dienen de patiënten conform de richtlijn minimaal 1. een behandeling met een selectieve serotonineheropnameremmer (SSRI) of serotonine-noradrenalineheropnameremmer (SNRI), 2. behandeling met clomipramine en 3. één combinatiebehandeling van een antidepressivum met een antipsychoticum te hebben gebruikt. Hierbij is het van belang dat medicatie ≥ 12 weken conform de aanbevolen, maximale dosering is ingenomen, bijvoorbeeld citalopram 60 mg/d, sertraline 200 mg/d en clomipramine met een spiegel > 200 µg/l. Qua antipsychoticumadditie is er een voorkeur voor risperidon of aripiprazol.13 Van de medicamenteuze criteria kan worden afgeweken wanneer verhoging onmogelijk is door bijwerkingen, de aanbevolen dosering niet wordt verdragen, of wanneer sprake is van farmacogenetische afwijkingen die aanpassing van de dosering noodzakelijk maken. In de huidige literatuur wordt beschreven dat 10-25% van de patiënten met OCS, ondanks deze behandelingen, therapieresistent blijkt.2,3
Ervaring leert dat bij verwijzing voor DBS veel patiënten niet conform het behandelprotocol zijn behandeld, wat leidt tot pseudoresistentie. In dat geval wordt verdere behandeling conform protocol geadviseerd waarbij DBS pas aan de orde is als de nog beschikbare andere behandelopties ook onvoldoende effect hebben.
Ernst
OCS wordt als dermate ernstig geclassificeerd dat DBS geïndiceerd is, wanneer één van de volgende situaties van toepassing is: 1. totaalscore op de Yale-Brown Obsessive-Compulsive Scale (Y-BOCS; een meetinstrument voor ernst van obsessies en compulsies) ≥ 28;14 2. Y-BOCS-score ≥ 14, als er sprake is van enkel obsessies of compulsies; of 3. > 8 uur/dag spenderen aan obsessies en/of compulsies. Subjectieve lijdensdruk wordt expliciet meegenomen in de beoordeling.
Contra-indicaties
Er zijn verschillende contra-indicaties. Als exclusiecriterium geldt het onvermogen om een geïnformeerde beslissing te nemen. Daarnaast een (actuele) primaire stoornis in het psychotische spectrum vanwege risico op toename van de psychotische symptomen na DBS. Verder neurologische degeneratieve aandoeningen of primaire dan wel structurele hersenafwijkingen die interfereren met DBS. Er zijn ook algemene maar zeldzame chirurgische contra-indicaties zoals een verhoogde bloedingsneiging of immuundeficiëntie.
Andere contra-indicaties zijn ernstige problemen in de impulsbeheersing – waaronder bij ernstige ADHD, laagbegaafdheid, ernstige persoonlijkheidsproblematiek of recent middelenmisbruik – vanwege risico op toegenomen impulsiviteit na DBS.
Voor DBS geldt de absolute voorwaarde om een langdurige therapeutische behandelrelatie aan te gaan. Ernstige persoonlijkheids- of ontwikkelingsstoornis of instabiele psychosociale omstandigheden kunnen dit verstoren. Ten slotte kunnen er praktische belemmeringen zijn (bijv. onvermogen te reizen), sociale (bijv. afwezig steunsysteem) of somatische (bijv. ernstige vermoeidheid of instabiele somatische situatie) of cognitieve (bijv. ernstige cognitieve functiestoornissen) belemmeringen die ofwel het veilig uitvoeren van DBS ofwel de potentie tot verandering door DBS dermate in de weg staan dat ze een (relatieve) contra-indicatie vormen.
In het verleden werden comorbide bipolaire stoornis en autismespectrumstoornis als contra-indicaties beschouwd. Recente casusbeschrijvingen van het Amsterdam UMC laten zien dat DBS voor OCS effectief en veilig kan worden toegepast bij patiënten met bipolaire stoornis of autismespectrumstoornis en deze niet als strikte exclusiecriteria gelden,15,16 met de juiste preventieve stemmingsstabilisatie, c.q. ondersteuning bij de autismespectrumstoornis. Comorbide persoonlijkheidsstoornissen zonder ernstige impulscontroleproblematiek die de behandelrelatie niet al te zeer belemmeren, zijn geen exclusiecriterium.17
Procedure indicatiestelling
Patiënten worden verwezen naar een expertisecentrum DBS bij OCS. Momenteel worden nagenoeg alle patiënten behandeld in het Amsterdam UMC of het Maastricht UMC+. Het Elizabeth Tweesteden Ziekenhuis participeert in onderzoek van het Amsterdam UMC naar DBS bij depressie, het UMCG is gestart met includeren van patiënten met OCS voor DBS, andere centra treffen voorbereidingen.
Na verwijzing worden patiënten ingepland voor een intake onder supervisie van ten minste één gespecialiseerd psychiater. De diagnose primaire OCS wordt bevestigd dan wel verworpen, en overige in- en exclusiecriteria worden nagelopen. Intakes worden besproken tijdens een multidisciplinaire intakevergadering. Als besloten wordt dat een patiënt in aanmerking komt voor DBS, vindt een screening plaats inclusief diagnostisch onderzoek, psychometrie, (neuro)psychologisch onderzoek, laboratoriumonderzoek en beeldvorming van de hersenen (MRI). Belangrijke aspecten zijn ook de verwachtingen van de behandeling en de doelen van de patiënt, alsmede de praktische haalbaarheid (zoals het regelmatig bezoeken van het ziekenhuis).
In een multidisciplinair DBS-overleg met psychiaters, psychologen, verpleegkundigen en neurochirurgen worden de resultaten van de screeningsonderzoeken besproken, waarin gezamenlijk een beslissing wordt genomen over de indicatiestelling. In het geval van een negatief besluit worden eventuele andere behandelopties besproken. Tijdens terugkoppeling aan patiënt, systeem en verwijzer worden praktische zaken (zoals wachttijd tot operatie) en eventuele aandachtspunten besproken (bijv. inschakelen van thuiszorg na de operatie) inclusief psychiatrische risico’s zoals (hypo)manische ontregeling.
De beslissing tot DBS kan langdurig en ingewikkeld zijn door het ervaren last-resortkarakter van de behandeling. Dikwijls geven patiënten aan zich te zullen suïcideren of euthanasie te zullen aanvragen als DBS geen optie is, om hun lijdensdruk te onderstrepen. Indicatie voor DBS vergt daarom een zorgvuldige medisch-ethische afweging waarbij de verwachte voor- en nadelen van DBS voor iedere patiënt individueel worden afgewogen. Regelgeving en wachtlijsten kunnen de procedure compliceren.
Implantatiefase
Gesprek neurochirurg
In een preoperatief gesprek geeft de neurochirurg uitleg over de ingreep en de risico’s van de operatie, zoals infectie, bloeding ter plaatse van de hersenelektrode of neurostimulator, en defect, storing of uitvallen van het DBS-systeem met risico op heroperatie (zie ook onder het subkopje ‘Perioperatieve complicaties’). De anesthesioloog voert een preoperatieve screening uit.
Op basis van een MRI-scan in het kader van de screening, wordt preoperatief een planning gemaakt hoe de elektrodes zullen worden geplaatst. Niet alleen de doellocatie, maar ook de veilige route ernaartoe wordt exact gepland. Sommige centra maken een CT-scan met contrast om bloedvaten te lokaliseren.
Operatie
Patiënten worden opgenomen op de afdeling Neurochirurgie of Psychiatrie. Vooraf wordt chronisch benzodiazepinegebruik in principe afgebouwd omdat het sederende en anxiolytische effect de verbetering na DBS met postoperatieve CGT kan verstoren. Ook kan men overwegen om serotonerge medicatie af te bouwen vanwege verhoogd bloedingsrisico.
De operatie vindt plaats onder algehele narcose. Er wordt een stereotactisch frame geplaatst om implantatie van de elektrodes mogelijk te maken. Na het bevestigen van het frame wordt een MRI- of CT-scan gemaakt ter referentie. Hierna worden twee incisies gemaakt in de hoofdhuid en twee boorgaten, waarna de elektrodes worden ingebracht op de vooraf bepaalde locaties en verankerd aan de schedel. Vervolgens wordt de neurostimulator onderhuids ingebracht op de borstwand onder de clavicula of in de buik, waarbij verlengkabels die onder de huid worden doorgevoerd de elektrodes met de neurostimulator verbinden. Ten slotte wordt getest of het DBS-systeem goed functioneert en verbonden is.
De operatieduur bedraagt ongeveer 4 uur. De patiënt ontwaakt op de verkoeverkamer en houdt de dag van de operatie bedrust. Er wordt ter controle een CT-scan gemaakt om de positie van de elektrodes te bevestigen. Op indicatie kan een postoperatieve CT-scan worden gemaakt om bloedingen uit te sluiten. Eén tot uiterlijk zeven dagen na de operatie kan de patiënt met ontslag.
Plaatsing elektrodes
Er worden verschillende doellocaties voor de elektrodes beschreven, die verschillen tussen centra, maar ook binnen centra over de tijd.7 Het gebeurt dat voor dezelfde locaties verschillende termen worden gebruikt. Bovendien is het contactpunt van de doellocatie niet noodzakelijk het contactpunt dat effectief is (figuur 2). Omdat een elektrode meerdere contactpunten heeft, kan de plek waar de elektrische pulsen worden afgegeven, verschillen van de doellocatie waar de punt van de elektrode geplaatst wordt.
Figuur 2. Schematische weergave van de ligging van de elektrodes in de hersenen
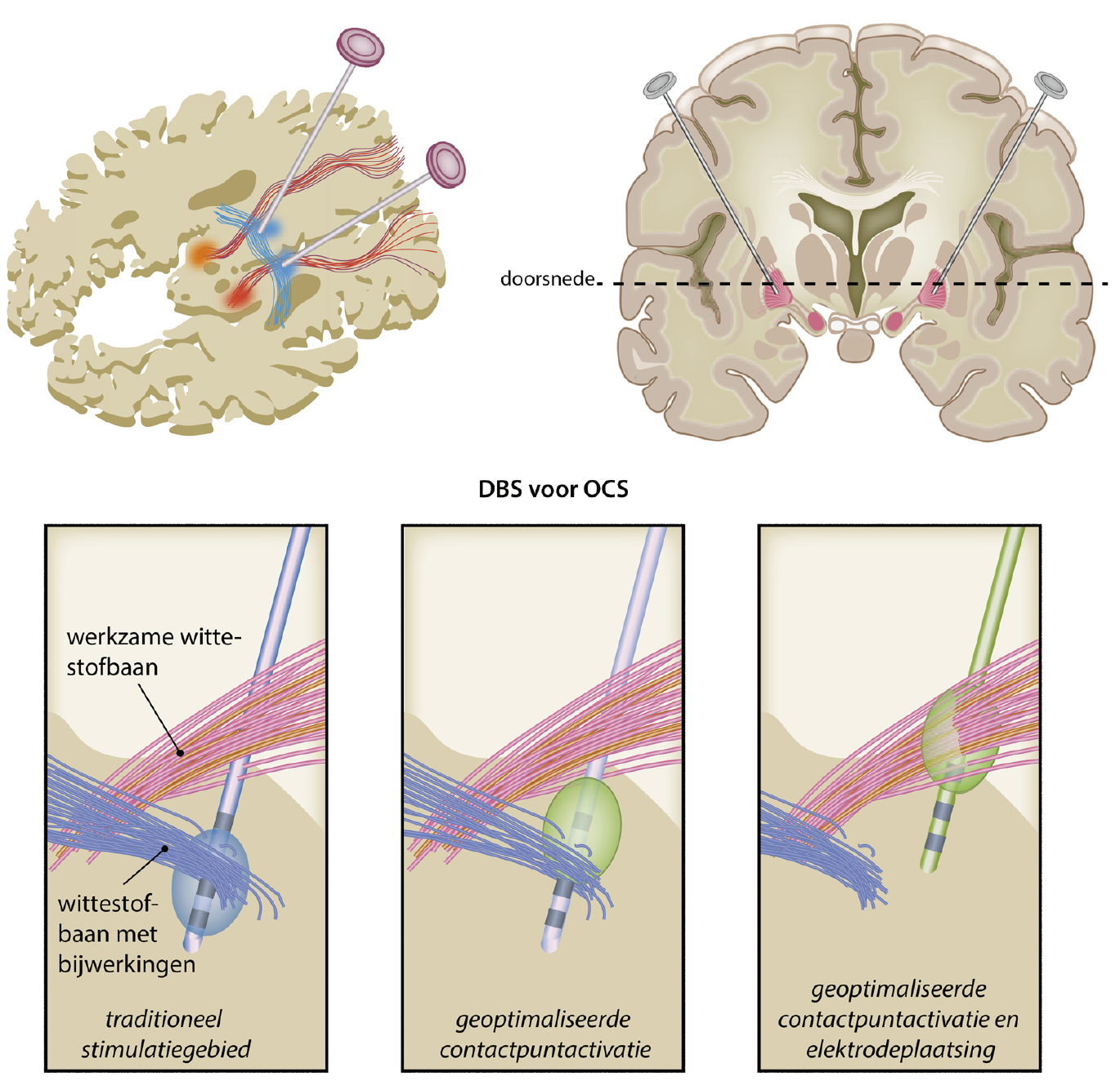
In het linker paneel wordt een wittestofbaan geassocieerd met bijwerkingen gestimuleerd. Het middelste paneel toont activatie van andere contactpunten resulterend in minder bijwerkingen. Het rechter paneel toont geoptimaliseerde plaatsing van de elektrode waardoor het stimulatiegebied voornamelijk overlapt met de wittestofbanen geassocieerd met positieve effecten.
Voor OCS is de ventrale capsula/het ventrale striatum (VC/VS) als doellocatie het bekendst.6 Eerder werd binnen dit gebied de nucleus accumbens (NAc) als doellocatie gebruikt, waarbij de onderste twee contactpunten van de elektrode in de NAc lagen en de bovenste twee in het ventrale voorste been van de capsula interna (ventral anterior limb of the internal capsule, vALIC). Later werd het onderste contactpunt in de NAc geplaatst met de drie bovenste in de vALIC.3,4 Omdat de werkzame contactpunten in de vALIC bleken te liggen worden de elektrodes in de vALIC geïmplanteerd, onder een anterieure hoek van ongeveer 75° ten opzichte van de intercommissurale lijn waarbij het ventrale contactpunt anterieur van de commissura anterior wordt geplaatst.18
Diffusion tensor imaging (DTI) laat zien dat plaatsing in specifieke wittestofbundels geassocieerd is met snellere en/of meer verbetering met mogelijk minder bijwerkingen.19-21 Daarom wordt nu preoperatieve tractografie gebruikt om de wittestofdoellocatie te bepalen.22 Samen met het gegeven dat de diverse gebruikte targets vergelijkbaar grote effecten laten zien en onderling verbonden zijn, suggereert dit een onderliggend neurocircuit dat beïnvloed wordt conform het principe van connectomische stimulatie.19-22
Hardware
Er zijn verschillende (commerciële) fabrikanten van DBS-systemen. Er zijn subtiele verschillen tussen de modellen binnen en tussen de fabrikanten, bijvoorbeeld in de positie en het aantal contactpunten. DBS-systemen zijn een medisch hulpmiddel en vallen onder de Europese wetgeving voor medische hulpmiddelen. Voor klinische toepassing dient de fabrikant een Conformité Européenne(CE)-markering aan te vragen. Omdat de psychiatrische markt momenteel kleiner is dan de neurologische markt, vragen fabrikanten niet voor alle DBS-systemen de relatief kostbare procedure voor psychiatrische indicaties aan. Hierdoor is er momenteel geen elektrode met CE-markering voor OCS voorhanden. Gelukkig hoeft dit klinische toepassing van DBS niet in de weg te staan. Behandeling met DBS-systemen zonder CE-markering is wel toegestaan in onderzoeksverband. Dit hoeft geen interventiestudie te betreffen, maar kan ook om een observationele registratiestudie gaan. Wel pleiten wij voor een update van de regelgeving die beter aansluit bij de klinische praktijk en verdere innovatie faciliteert in plaats van daaraan in de weg te staan.
Tijdens implantatie wordt er bij iedere patiënt een niet-oplaadbare of een oplaadbare neurostimulator geplaatst. De levensduur van de batterij is afhankelijk van de DBS-parameters (aantal geactiveerde contactpunten, stroomsterkte, etc.). Voor de meeste patiënten met OCS is de levensduur van een niet-oplaadbare batterij 1-2 jaar. Een oplaadbare neurostimulator heeft een levensduur van ≥ 15 jaar. Een nadeel van dit type stimulator is dat deze 1-4 keer per week moet worden opgeladen door de patiënt waarbij de oplaadfrequentie afhankelijk is van de ingestelde parameters.
Perioperatieve complicaties
De kans tijdens de DBS-operatie op een bloeding rondom de in de hersenen gelegen elektrode of de onderhuids gelegen neurostimulator is < 1% en op infectie 3%. Een bloeding rondom de in de hersenen gelegen elektrode blijkt in de praktijk nauwelijks tot geen verschijnselen te veroorzaken en wordt slechts als toevalsbevinding gezien op een postoperatieve scan. Een bloeding rondom de onderhuidse neurostimulator kan pijnklachten veroorzaken of de wondgenezing compromitteren en wordt dan operatief verwijderd. Infecties kunnen zichtbaar worden door niet goed genezen van de littekens, of dehiscentie van het litteken met roodheid, pus en/of vocht. Infecties zijn niet zichtbaar in de eerste week, ze kunnen zowel in een vroeg stadium (eerste 2 weken) als in een wat later stadium (2-12 weken) zichtbaar worden. Infectie kan chirurgische verwijdering van het DBS-systeem vergen met herplaatsing na 8-12 weken.23 Men kan ook kiezen voor chirurgische exploratie (met al dan niet vervangen van een onderdeel van het DBS-systeem) in combinatie met langdurige (12 weken) antibiotica.23
Optimalisatiefase
Ongeveer twee weken na de operatie wordt gestart met de optimalisatiefase waarbij de instellingen worden aangepast totdat een stabiel effect is bereikt. De behandelaar maakt contact met de neurostimulator via een telemetrieverbinding. Met een afstandsbediening of tablet kan men de actieve contactpunten kiezen en kan men de pulsbreedte, stimulusfrequentie en spanning of stroomsterkte aanpassen volgens een gestandaardiseerd schema. Er wordt over het algemeen hoogfrequente stimulatie toegepast (130 Hz), met een pulsbreedte van 90 μs. Op basis van de lokalisatie van de elektrode worden één of meerdere contactpunten geactiveerd. Het voltage of ampèrage wordt geleidelijk opgebouwd om het maximale effect met zo gering mogelijke bijwerkingen te achterhalen.
Bij het optreden van onhoudbare of onacceptabele bijwerkingen kunnen de instellingen (tijdelijk) worden aangepast. Bij onvoldoende effect kan men de pulsbreedte vergroten, de actieve contactpunten veranderen of kan men overgaan van monopolaire naar bipolaire stimulatie. De instelfase wisselt in duur, voor de meeste patiënten duurt deze tussen één en zes maanden.
Effect
Uit een recente meta-analyse van 34 studies met een totaal van 352 patiënten bleek dat OCS-symptomen gemiddeld met 47% afnamen (95%-BI: 40-53%), waarbij 66% van de patiënten als responder (≥ 35% afname in Y-BOCS) kon worden geclassificeerd (95%-BI: 57-74%).6 Er werd geen verschil gevonden tussen de verschillende targets. Naast afname van OCS-symptomen was er 40% afname van depressieve symptomen (Hedges’ g = 1,0). In gerandomiseerde trials werd bovendien een groot verschil gevonden tussen actieve DBS en placebo-DBS (Hedges’ g = 0,9).7,24
In studies van het Amsterdam UMC (n = 70) en Maastricht UMC+ (n = 8) werden vergelijkbare responspercentages van 52-63% gezien,4,21 met daarnaast 17% gedeeltelijke responders (≥ 25% maar < 35% afname in Y-BOCS).4 Helaas ervaart 31% van de patiënten < 25% afname op de Y-BOCS. Gemiddelde afname in OCS-symptomen was respectievelijk 62% bij responders, 29% bij gedeeltelijke responders en 10% bij non-responders.4 Verbetering bleef stabiel over een follow-up van gemiddeld 4,25 tot > 10 jaar en de gemiddelde kwaliteit van leven op langere termijn verbetert tot nagenoeg het gemiddelde van de Nederlandse bevolking.4,5,9 Ook liet kosteneffectiviteitsonderzoek zien dat DBS kosteneffectief en kostenbesparend is.10
Bij uitblijven van effect en/of ondraaglijke bijwerkingen kan men kiezen voor het uitzetten van DBS of zelfs het verwijderen van de elektrodes, de verlengkabels en/of de neurostimulator, waarvan tot op heden geen restschade is gerapporteerd. Dit maakt DBS tot een veilige en reversibele ingreep. In het Amsterdam UMC is het DBS-systeem in de afgelopen 20 jaar bij 2 patiënten geëxplanteerd (< 2%). Voordat tot explantatie wordt overgegaan, is het aanbevelenswaardig om de stimulator eerst uit te zetten. In deze periode kan men evalueren of er toch positief effect is omdat sommige patiënten na langdurige behandeling het effect van DBS onderschatten.
Bijwerkingen
Bijwerkingen gerelateerd aan de stimulatie zijn tijdelijk van aard en hangen samen met de stimulatielocatie en -parameters. Na activering of verandering van de stimulusparameters kunnen hypomane symptomen (39%) ontstaan, waaronder motorische onrust (33%), agitatie (30%), impulsiviteit (19%) en slaapproblemen (46%; waarvan 7% permanent). De hypomane symptomen verdwijnen vaak vanzelf of na aanpassing van stimulusparameters. In uiterste gevallen kan (tijdelijke) medicamenteuze behandeling noodzakelijk zijn.
Op de langere termijn rapporteert ongeveer de helft van de patiënten cognitieve klachten zoals geheugen- en concentratieproblemen, die echter niet met neuropsychologisch onderzoek worden geobjectiveerd.
Ook rapporteert ongeveer de helft van de patiënten vermoeidheidsklachten als bijwerking.5 Het is echter onduidelijk in hoeverre dit samenhangt met DBS, omdat de vermoeidheid meestal ook al aanwezig was voor de DBS-behandeling. In 8% van de gevallen werd er wel een relatie tussen vermoeidheid en DBS verondersteld.
Daarnaast kunnen patiënten last rapporteren van zichtbaarheid en/of tractie van het DBS-systeem en de kabels. Er zijn ten slotte ook vreemde bijwerkingen beschreven waaronder de neiging om met de hand tegen de neurostimulator te drukken of om alleen naar Johnny Cash te luisteren.25,26
Van de patiënten met OCS die met DBS werden behandeld, deed 4% een suïcidepoging, één patiënt pleegde daadwerkelijk suïcide.4,5,15 Het is onduidelijk óf en hoe suïcidaliteit is geassocieerd met DBS. De doelpopulatie heeft een verhoogd suïciderisico vanwege de therapieresistentie en de hoge mate waarin depressie als comorbide stoornis voorkomt. Suïcidaliteit kan hiernaast samenhangen met teleurstelling in de effecten bij non-responders op DBS, maar ook met comorbide persoonlijkheids-, autismespectrum- of stemmingsstoornissen.4,5,15 Belangrijk is dat de pogingen en suïcide(s) in tijd niet gerelateerd waren aan veranderingen in stimulatieparameters, wat erop duidt dat de suïcidaliteit niet door DBS verklaard kan worden. De geslaagde suïcide was gerelateerd aan medicatieverandering bij een comorbide ernstige depressieve stoornis.4,5,15
Consolidatiefase
Als de meest optimale instellingen zijn gevonden, gaat de optimalisatiefase over in de consolidatiefase. Deze richt zich op het behouden van de effecten van DBS en op een zo groot mogelijk herstel van functioneren en kwaliteit van leven.
Opvallend is dat naast effecten op de OCS-symptomen ook effecten worden gezien op stemmings- en angstklachten. Hierdoor ontstaan mogelijkheden om te behandelen met CGT, omdat patiënten de exposure-oefeningen beter durven uit te voeren. De evidentie voor de effectiviteit van CGT na DBS is echter onhelder. In sommige studies observeerde men een verdere verbetering van psychiatrische symptomen na CGT, maar andere studies lieten zien dat de daling ook optrad bij patiënten met DBS die geen CGT kregen.27-29 Dit suggereert dat de verbetering ook aan DBS kan worden toegeschreven onafhankelijk van CGT.28
Gezien de abrupte verbetering van zeer lang bestaande OCS, stemmings- en angstsymptomen vergt het patiënten en hun omgeving tijd om te wennen aan de nieuwe situatie. Het behandelteam kan meedenken hoe de tijd die eerst werd besteed aan dwangklachten op een zingevende manier kan worden ingevuld, en hoe patronen binnen het systeem van patiënt kunnen worden veranderd. Na DBS kan 22% van de patiënten met OCS de psychotrope medicatie staken en 20% kan deze afbouwen.5
Discussie
DBS is een effectieve en veilige behandeloptie voor ernstige, therapieresistente OCS. Een meta-analyse van 34 studies met 352 patiënten wereldwijd laat zien dat er relatief weinig bijwerkingen zijn en zeer grote positieve effecten gedurende lange follow-up op zowel symptomen als functioneel herstel.6
Desalniettemin wordt DBS relatief spaarzaam toegepast in de psychiatrie.24,30,31 In Nederland wordt DBS vergoed vanuit de basiszorgverzekering, maar het aantal DBS-behandelingen is veel lager dan op basis van de epidemiologie van therapieresistente OCS kan worden verwacht. Mogelijk dat een uniform landelijk behandelprotocol hier een positieve bijdrage aan kan leveren. In het huidige artikel beschreven we voor het eerst een landelijke consensus als aanzet tot een dergelijk protocol vanuit de nationale Multidisciplinaire Werkgroep DBS in de Psychiatrie.
DBS in de psychiatrie ontwikkelt zich van een verleden van pionieren naar momenteel uitbreiding en consolidatie. De eerste studies waren gevalsbeschrijvingen over optimaal geselecteerde patiënten,32-34 inmiddels zijn er verschillende gerandomiseerde-gecontroleerde studies en relatief grote naturalistische cohortonderzoeken gepubliceerd.4-6 Comorbiditeit die voorheen als contra-indicatie gold, blijkt effectieve en veilige toepassing van DBS niet in de weg te staan,15,16 wat mogelijkheden biedt voor toepassing bij meer patiënten. Naast DBS voor OCS worden indicaties onderzocht zoals unipolaire depressieve stoornis en anorexia nervosa, met hoopgevende resultaten.35-37
Tegelijkertijd staat de meer fundamentele technologische ontwikkeling van DBS niet stil. Meer geavanceerde beeldvormende technieken bij grotere aantallen patiënten bieden beter inzicht in de optimale stimulatielocatie en werkingsmechanismes.20,22,38 De focus komt daarbij steeds meer te liggen op onderliggende (gepersonaliseerde) neurocircuits in plaats van grijzestoftargets. Nieuw ontwikkelde elektrodes die gelijktijdig kunnen stimuleren en meten kunnen inzicht bieden in de elektrofysiologische effecten en vormen mogelijk een opmaat naar closed-loop-DBS, waarin de stimulatie realtime wordt afgestemd op metingen van afwijkende hersenactiviteit.39 Daarnaast zijn er directionele DBS-elektrodes ontwikkeld, waarbij de pulsjes 360° rondom gestuurd kunnen worden. Dit kan zorgen voor minder bijwerkingen en minder stroomverbruik. Verder werden preoperatieve predictoren van respons onderzocht.8,17,40
Al met al geven we met deze consensusverklaring een overzicht van de huidige stand van zaken van de wetenschap op het gebied van DBS voor OCS, als aanzet tot een landelijk uniform protocol. Daarmee willen we een bijdrage leveren aan de bekendheid en de implementatie van DBS, om zo meer patiënten te kunnen ondersteunen in hun herstel van ernstige, therapieresistente OCS.
Literatuur
1 Stein DJ, Costa DLC, Lochner C, e.a. Obsessive-compulsive disorder. Nat Rev Dis Primers 2019; 5: 52.
2 van Grootheest DS, van den Heuvel OA, Cath DC, e.a. Obsessieve-compulsieve stoornis. Ned Tijdschr Geneeskd 2008; 152: 2325-9.
3 Denys D, Mantione M, Figee M, e.a. Deep brain stimulation of the nucleus accumbens for treatment-refractory obsessive-compulsive disorder. Arch Gen Psychiatry 2010; 67: 1061-8.
4 Denys D, Graat I, Mocking R, e.a. Efficacy of deep brain stimulation of the ventral anterior limb of the internal capsule for refractory obsessive-compulsive disorder: a clinical cohort of 70 patients. Am J Psychiatry 2020; 177: 265-71.
5 Graat I, Mocking R, Figee M, e.a. Long-term outcome of deep brain stimulation of the ventral part of the anterior limb of the internal capsule in a cohort of 50 patients with treatment-refractory obsessive-compulsive disorder. Biol Psychiatry 2021; 90: 714-20.
6 Gadot R, Najera R, Hirani S, e.a. Efficacy of deep brain stimulation for treatment-resistant obsessive-compulsive disorder: systematic review and meta-analysis. J Neurol Neurosurg Psychiatry 2022; doi: 10.1136/jnnp-2021-328738.
7 Bergfeld IO, Dijkstra E, Graat I, e.a. Invasive and non-invasive neurostimulation for OCD. Curr Top Behav Neurosci 2021; 49: 399-436.
8 Alonso P, Cuadras D, Gabriels L, e.a. Deep brain stimulation for obsessive-compulsive disorder: a meta-analysis of treatment outcome and predictors of response. PLoS One 2015; 10: e0133591.
9 Ooms P, Mantione M, Figee M, e.a. Deep brain stimulation for obsessive-compulsive disorders: long-term analysis of quality of life. J Neurol Neurosurg Psychiatry 2014; 85: 153-8.
10 Ooms P, Blankers M, Figee M, e.a. Cost-effectiveness of deep brain stimulation versus treatment as usual for obsessive-compulsive disorder. Brain Stimul 2017; 10: 836-42.
11 Arns M, Bervoets C, van Eijndhoven P, e.a. Consensusverklaring voor de toepassing van rTMS bij depressie in Nederland en België. Tijdschr Psychiatr 2019; 61: 411-20.
12 van Belkum SM, de Boer MK, Taams GJ, e.a. Repetitieve transcraniële magnetische stimulatie bij therapieresistente depressie; voorstel voor een behandelprotocol. Tijdschr Psychiatr 2018; 60: 766-73.
13 Veale D, Miles S, Smallcombe N, e.a. Atypical antipsychotic augmentation in SSRI treatment refractory obsessive-compulsive disorder: a systematic review and meta-analysis. BMC Psychiatry 2014; 14: 317.
14 Goodman WK, Price LH, Rasmussen SA, e.a. The Yale-Brown Obsessive Compulsive Scale. I. Development, use, and reliability. Arch Gen Psychiatry 1989; 46: 1006-11.
15 Graat I, Balke S, Prinssen J, e.a. Effectiveness and safety of deep brain stimulation for patients with refractory obsessive compulsive disorder and comorbid autism spectrum disorder; A case series. J Affect Disord 2022; 299: 492-7.
16 Graat I, van Rooijen G, Mocking R, e.a. Is deep brain stimulation effective and safe for patients with obsessive compulsive disorder and comorbid bipolar disorder? J Affect Disord 2020; 264: 69-75.
17 Graat I, Mocking RJT, de Koning P, e.a. Predicting response to valic deep brain stimulation for refractory obsessive-compulsive disorder. J Clin Psychiatry 2021; 82: 20m13754.
18 van den Munckhof P, Bosch DA, Mantione MH, e.a. Active stimulation site of nucleus accumbens deep brain stimulation in obsessive-compulsive disorder is localized in the ventral internal capsule. Acta Neurochir Suppl 2013; 117: 53-9.
19 Liebrand LC, Caan MWA, Schuurman PR, e.a. Individual white matter bundle trajectories are associated with deep brain stimulation response in obsessive-compulsive disorder. Brain Stimul 2019; 12: 353-60.
20 Baldermann JC, Schuller T, Kohl S, e.a. Connectomic deep brain stimulation for obsessive-compulsive disorder. Biol Psychiatry 2021; 90: 678-88.
21 van der Vlis TAMB, Ackermans L, Mulders AEP, e.a. Ventral capsule/ventral striatum stimulation in obsessive-compulsive disorder: toward a unified connectomic target for deep brain stimulation? Neuromodulation 2021; 24: 316-23.
22 Graat I, Mocking RJT, Liebrand LC, e.a. Tractography-based versus anatomical landmark-based targeting in vALIC deep brain stimulation for refractory obsessive-compulsive disorder. Mol Psychiatry 2022; 27: 5206-12.
23 Bouwens van der Vlis TAM, van de Veerdonk M, Ackermans L, e.a. Surgical and hardware-related adverse events of deep brain stimulation: a ten-year single-center experience. Neuromodulation 2022; 25: 296-304.
24 van Wingen G, Bergfeld I, de Koning P, e.a. Comment to: Deep brain stimulation for refractory obsessive-compulsive disorder (OCD): emerging or established therapy? Mol Psychiatry 2022; 27: 1276-7.
25 Mantione M, Figee M, Denys D. A case of musical preference for Johnny Cash following deep brain stimulation of the nucleus accumbens. Front Behav Neurosci 2014; 8: 152.
26 Graat I, van Rooijen G, Prinsen J, e.a. Cyclic versus continuous deep brain stimulation in patients with obsessive compulsive disorder: A randomized controlled trial. Brain Stimul 2023; 16: 82-7.
27 Görmezoğlu M, Bouwens van der Vlis T, Schruers K, e.a. Effectiveness, timing and procedural aspects of cognitive behavioral therapy after deep brain stimulation for therapy-resistant obsessive compulsive disorder: a systematic review. J Clin Med 2020; 9: 2383.
28 Graat I, Franken S, van Rooijen G, e.a. Cognitive behavioral therapy in patients with deep brain stimulation for obsessive-compulsive disorder: a matched controlled study. Psychol Med 2022: 53: 5861-7.
29 Mantione M, Nieman DH, Figee M, e.a. Cognitive-behavioural therapy augments the effects of deep brain stimulation in obsessive-compulsive disorder. Psychol Med 2014; 44: 3515-22.
30 Mocking RJT, Graat I, Denys D. Why has deep brain stimulation had so little impact in psychiatry? Front Neurol 2021; 12: 757142.
31 Visser-Vandewalle V, Andrade P, Mosley PE, e.a. Deep brain stimulation for obsessive-compulsive disorder: a crisis of access. Nat Med 2022; 28: 1529-32.
32 Nuttin B, Cosyns P, Demeulemeester H, e.a. Electrical stimulation in anterior limbs of internal capsules in patients with obsessive-compulsive disorder. Lancet 1999; 354: 1526.
33 Nuttin B, Wu H, Mayberg H, e.a. Consensus on guidelines for stereotactic neurosurgery for psychiatric disorders. J Neurol Neurosurg Psychiatry 2014; 85: 1003-8.
34 Wu H, Hariz M, Visser-Vandewalle V, e.a. Deep brain stimulation for refractory obsessive-compulsive disorder (OCD): emerging or established therapy? Mol Psychiatry 2021; 26: 60-5.
35 Karaszewska D, Cleintuar P, Oudijn M, e.a. Efficacy and safety of deep brain stimulation for treatment-refractory anorexia nervosa: a systematic review and meta-analysis. Transl Psychiatry 2022; 12: 333.
36 Oudijn MS, Mocking RJT, Wijnker RR, e.a. Deep brain stimulation of the ventral anterior limb of the capsula interna in patients with treatment-refractory anorexia nervosa. Brain Stimul 2021; 14: 1528-30.
37 van der Wal JM, Bergfeld IO, Lok A, e.a. Long-term deep brain stimulation of the ventral anterior limb of the internal capsule for treatment-resistant depression. J Neurol Neurosurg Psychiatry 2020; 91: 189-95.
38 Hollunder B, Rajamani N, Siddiqi SH, e.a. Toward personalized medicine in connectomic deep brain stimulation. Prog Neurobiol 2022; 210: 102211.
39 Fridgeirsson EA, Bais M, Eijsker N, e.a. The ventral striatum harbours patient specific intracranial neural signatures of obsessions and compulsions. medRxiv 2021: 2021.04.04.21254830.
40 Ruan H, Wang Y, Li Z, e.a. A systematic review of treatment outcome predictors in deep brain stimulation for refractory obsessive-compulsive disorder. Brain Sci 2022; 12: 936.
Auteurs
Roel Mocking, psychiater en universitair hoofddocent, Amsterdam UMC.
Linda Ackermans, neurochirurg, Maastricht UMC+.
Isidoor Bergfeld, postdoctoraal onderzoeker, psycholoog i.o. tot GZ-psycholoog, Amsterdam UMC.
Maarten Bot, neurochirurg, Amsterdam UMC.
J. Marc C. van Dijk, hoogleraar Neurochirurgie, UMC Groningen.
Liesbet Goossens, neurowetenschapper, Maastricht UMC+.
Benno Haarman, psychiater en universitair docent, UMC Groningen.
Pelle de Koning, psychiater, Amsterdam UMC.
Albert Leentjens, psychiater, hoogleraar Neuropsychiatrie, afd. Psychiatrie, Maastricht UMC+.
David Linden, klinisch hoogleraar Psychiatrie, Maastricht UMC+.
Pepijn van den Munckhof, neurochirurg, Amsterdam UMC.
Yasmin Namavar, psychiater, polikliniek Angst en Dwang, Amsterdam UMC.
Marinus Oterdoom, neurochirurg, UMC Groningen.
Kamini Ho Pian, psychiater, UMC Groningen.
Geeske van Rooijen, psychiater, Dijklander Ziekenhuis, Hoorn en Purmerend.
Koen Schruers, psychiater, vakgroep Psychiatrie, Maastricht UMC+, Topklinisch Centrum Angst/Dwang/Trauma Mondriaan, Maastricht/Heerlen.
Rick Schuurman, hoogleraar Functionele Neurochirurgie, Amsterdam UMC.
Yasin Temel, hoogleraar Neurochirurgie, Maastricht UMC+.
Nienke Vulink, psychiater, Amsterdam UMC.
Damiaan Denys, hoogleraar Psychiatrie, Amsterdam UMC.
Namens de Multidisciplinaire Werkgroep DBS in de Psychiatrie.
Correspondentie
Dr. Roel Mocking (r.j.mocking@amsterdamumc.nl).
Strijdige belangen
Bergfeld meldde een onderzoeksgrant van ZonMw (nr. 636310016) en Boston Scientific; Schuurman meldde grants van Boston Scientific en Medtronic.
Het artikel werd voor publicatie geaccepteerd op 6-6-2024.
Citeren
Tijdschr Psychiatr. 2024;66(7):387-394
